《表3 蛋白质二级结构的含量》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《酸法脱酰胺修饰对刺芹侧耳蛋白质消化性和功能特性的影响》
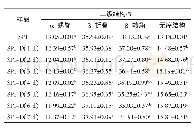
酰胺Ⅰ带、酰胺Ⅱ带和酰胺Ⅲ带是蛋白质红外光图谱三组特征吸收谱带,其常见波长范围分别为1 600–1 700cm-1、1 530–1 550cm-1和1 260–1 300cm-1 (Pandya et al.2013),其中常见的酰胺Ⅰ带主要以C=O双键伸缩振动,酰胺Ⅱ带形成的原因是由N-H弯曲振动引起,酰胺Ⅲ带主要表现在C-N伸缩振动和N-H弯曲振动(Jiang et al.2015)。当破坏了分子内或分子间的氢键时,酰胺Ⅱ带能快速地把分子内或分子间的氢键结合得情况反映出来,谱带将向高波数移动(许彩虹2010)。结果表明,在波长1 000–1 200cm-1波段的吸收峰强度增加,这说明脱酰胺修饰能让刺芹侧耳蛋白质C=O键伸缩振动增强。在波长1 658cm-1波段的吸收峰有明显变化,说明经过脱酰胺修饰的刺芹侧耳蛋白质的二级空间结构发生变化(图6,图7)。经过脱酰胺改性后,刺芹侧耳蛋白质粉α螺旋的含量升高,β折叠和β转角的含量降低,而无规则卷曲变化不明显(表3)。
| 图表编号 | XD0067867700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.07.22 |
| 作者 | 孟俊龙、史瑞婕、常明昌、刘靖宇、程艳芬、冯翠萍 |
| 绘制单位 | 山西农业大学食品科学与工程学院、黄土高原食用菌提质增效协同创新中心、山西农业大学食品科学与工程学院、山西农业大学食品科学与工程学院、黄土高原食用菌提质增效协同创新中心、山西农业大学食品科学与工程学院、黄土高原食用菌提质增效协同创新中心、山西农业大学食品科学与工程学院、山西农业大学食品科学与工程学院、黄土高原食用菌提质增效协同创新中心 |
| 更多格式 | 高清、无水印(增值服务) |