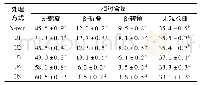
《表2 不同超声时间下蛋清蛋白质的二级结构含量》
注:同列肩标小写字母不同表示差异显著(P<0.05)。下同。
通常情况下,通过对酰胺I带进行定量分析,解析蛋白质二级结构[26]。由表2可知,随着超声时间的延长,蛋清蛋白质的α-螺旋结构含量先降低后增加,β-折叠结构含量持续减少,而无规卷曲和β-转角结构含量的变化相对不规律。这可能是由于前期的超声处理条件使蛋白质结构展开,蛋清蛋白趋于无序的状态,同时β-折叠含量的降低有利于蛋清液表面疏水性的增加[27]。后期的超声作用使α-螺旋含量增加,β-折叠含量继续减少,这可能是长时间的超声作用使分散的蛋白质分子再次发生聚集[28],或者高强度的超声作用改变了蛋白质氢键的取向,使蛋清蛋白质结构中β-折叠结构向α-螺旋结构转变。Chandrapala等[29]报道了在较强的超声强度下,蛋白质结构中发生β-折叠结构向α-螺旋结构转变的现象,与本研究结果一致。蛋白质的二级结构中,α-螺旋和β-折叠结构含有较多的氢键,无规卷曲和β-转角结构中不含有氢键;氢键能够影响蛋白质分子的刚性和柔性,α-螺旋和β-折叠含量因超声作用而降低,说明超声能够增加蛋白质分子的柔性结构。
| 图表编号 | XD0057432400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.05.15 |
| 作者 | 李弓中、赵英、王俊彤、迟玉杰 |
| 绘制单位 | 东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式