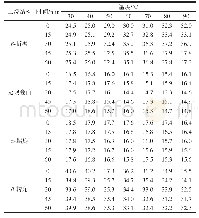
《表1 不同消化时间下大米谷蛋白二级结构相对含量》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《体外模拟消化对大米谷蛋白结构及水解产物生物活性的影响》
注:同列肩标小写字母不同表示差异显著(P<0.05)。下同。
消化过程中谷蛋白的酰胺I光谱进行去卷积,如图4所示。从开始消化到消化完成的5 h过程中中谷蛋白的酰胺I区域中出现谱带增加现象,表示在胰蛋白水解谷蛋白过程中,有新的羰基形成[24]。参考文献[13]对蛋白质二级结构与拟合图谱中各子峰对应关系,得出谷蛋白不同类型二级结构的相对含量,如表1所示。经过胰蛋白酶的消化后,谷蛋白二级结构发生了显著性变化(P<0.05)。在谷蛋白DH不断增加的过程中,α-螺旋相对含量显著增加(P<0.05),从22.36%增加至36.59%。胰蛋白酶水解0.5~1 h后,谷蛋白的α-螺旋结构相对含量略有增加,而β-折叠结构相对含量大幅减少,表明胰蛋白酶的水解使得蛋白的结构得以舒展,也对应了该阶段内源荧光光谱中色氨酸残基的荧光强度骤增的现象。在DH快速增大的2 h中,β-折叠相对含量显著降低,从29.32%降低至最低值8.51%(P<0.05),推测β-折叠的被胰蛋白酶水解。而β-转角相对含量从15.72%增加至最高值25.45%,随后呈现降低的趋势。而水解过程中无规卷曲相对含量并无明显变化。这与Xu Xingfeng等[25]使用圆二色光谱研究水解过程大米蛋白二级结构变化结果与本实验相似。Yong Yehui等[26]报道β-折叠是一种相对稳定的结构,而α-螺旋、β-转角和无规卷曲则相对比较灵活。以上结果表明谷蛋白在5 h的胰蛋白酶的水解过程中打开β-折叠结构,使得结构变得松散,使得胰蛋白酶更容易与谷蛋白结合,而水解更多活性肽段提供了可能。这也与谷蛋白水解过程内源荧光测定的结果具有一致性。
| 图表编号 | XD00207514200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.15 |
| 作者 | 石嘉怿、张太、梁富强 |
| 绘制单位 | 南京财经大学食品科学与工程学院、南京财经大学食品科学与工程学院、南京财经大学食品科学与工程学院 |
| 更多格式 | 高清、无水印(增值服务) |