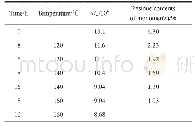
《表1 加热温度和时间对镜鲤鱼肌原纤维蛋白二级结构相对含量的影响》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《热处理温度及时间对镜鲤鱼肌原纤维蛋白热聚集行为的影响》
图6显示了不同热处理条件下的傅里叶变换红外光谱图。酰胺I带(1 600~1 700 cm-1)常被用于指示蛋白质二级结构的变化。该区域主要与多肽中N—H基团的平面内弯曲、C=O基团的伸缩振动以及肽键中C—N的伸缩振动有关[31]。表1为从酰胺I带获得的蛋白质二级结构的定量分析结果。30~90℃升温过程中蛋白β-折叠结构相对含量逐渐增加,α-螺旋结构相对含量逐渐减少;此外,当温度恒定时,随着保温时间的延长,蛋白β-折叠和α-螺旋结构相对含量与升温过程变化趋势相同。这意味着热处理诱导蛋白质变性、蛋白结构展开、蛋白二级结构转化[31]。蛋白α-螺旋结构相对含量降低、β-折叠结构相对含量增加,则表明蛋白具有形成强凝胶强度和高保水性凝胶的能力[32]。另外,30~40℃热处理过程蛋白质无规卷曲结构相对含量有所增加,这也表明蛋白质发生变性,结构展开。Liu Ru[7]、李鹏[33]等研究了猪肉、鸡肉、鱼肉蛋白结构与其凝胶特性的相关性,发现蛋白β-折叠结构相对含量的增加能够提高蛋白质凝胶性,此研究结果与本研究结果相似。
| 图表编号 | XD00207517300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.15 |
| 作者 | 畅鹏、谢艳英、王浩、夏秀芳 |
| 绘制单位 | 东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |