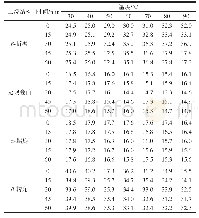
《表2 APPJ处理肌原纤维蛋白的二级结构相对含量变化》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《常压等离子体射流对鸡肉肌原纤维蛋白结构和流变特性的影响》
由图8和表2可见,与未处理组相比,APPJ处理的肌原纤维蛋白,有序的二级结构比例减少,α-螺旋相对含量从47.92%逐渐下降到26.21%。而β-折叠相对含量先显著增加,然后又降低,处理40 s后,与未处理组无显著差异(P>0.05)。β-转角相对含量从19.99%逐步增加到35.75%,无规卷曲相对含量从11.68%增加到22.97%。肽链中的全部肽键都可形成氢键,每个肽键都有由N—H和C=O的极性产生的偶极距,α-螺旋靠肽键间氢键维持稳定,α-螺旋中所有氢键都沿螺旋轴指向同一方向;β-折叠靠肽键的C=O和位于同一肽链或相邻肽链N—H之间形成的键间氢键维持;在APPJ处理肌原纤维蛋白的过程中,可能造成肌原纤维蛋白的链打开,氢键能力减弱。随着APPJ处理时间延长,二级结构的比例分布发生改变。二级结构中无序结构(β-转角和无规卷曲)含量增加,有序结构(α-螺旋和β-折叠)含量减少。Misra等[38]使用FTIR探究常压冷等离子体对小麦面粉的二级结构的影响,发现在短时间内常压冷等离子体处理的小麦面粉中平行和反平行β-折叠含量减少,α-螺旋和β-转角含量上升;Dong Shuang等[39]研究发现,在不同压强和处理时间,常压冷等离子体轻微的影响了玉米醇溶蛋白的二级结构;Sharifian等[12]报道了DBD的等离子体显著影响了牛肉里脊肌原纤维蛋白二级结构相对含量。等离子体处理10 min的牛肉肌原纤维蛋白α-螺旋含量下降,蛋白质结构展开,结构的可变动性增强。处理20 min后,β-折叠和β-转角含量增加,表明肌原纤维蛋白发生聚集。综上所述,APPJ作用于肌原纤维蛋白,会影响肌原纤维蛋白的解折叠与聚集程度,应注意APPJ直接放电时间。
| 图表编号 | XD00225601700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.15 |
| 作者 | 李可、李燕、康超娣、相启森、赵电波、白艳红 |
| 绘制单位 | 郑州轻工业大学食品与生物工程学院河南省冷链食品质量安全控制重点实验室食品生产与安全河南省协同创新中心、郑州轻工业大学食品与生物工程学院河南省冷链食品质量安全控制重点实验室食品生产与安全河南省协同创新中心、郑州轻工业大学食品与生物工程学院河南省冷链食品质量安全控制重点实验室食品生产与安全河南省协同创新中心、郑州轻工业大学食品与生物工程学院河南省冷链食品质量安全控制重点实验室食品生产与安全河南省协同创新中心、郑州轻工业大学食品与生物工程学院河南省冷链食品质量安全控制重点实验室食品生产与安全河南省协同创新中心、 |
| 更多格式 | 高清、无水印(增值服务) |