《表4 发酵过程中酸肉蛋白二级结构相对含量的变化》
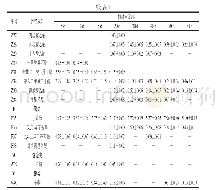
由表4可知,发酵0 d蛋白α-螺旋相对含量最高,无规卷曲最低。随发酵进行,α-螺旋和β-转角相对含量逐渐下降;β-折叠呈上升趋势,发酵140 d时超过α-螺旋成为二级结构中主体元素;无规卷曲变化趋势与α-螺旋变化基本相反。这可能是发酵使α-螺旋解旋生成β-折叠或无规卷曲以及β-转角和β-折叠相互转化,使α-螺旋、β-转角相对含量逐渐下降,β-折叠和无规卷曲相对含量上升。有报道[31]指出p H值从7.0降至5.0时,α-螺旋减少、β-折叠增多;Na Cl添加量增加,猪肉糜蛋白α-螺旋、β-转角降低,而β-折叠和无规卷曲上升[32],这与本研究变化趋势相似。表明酸肉发酵中添加的食盐及发酵产酸均导致了蛋白质二级结构的变化。其中,发酵80~110 d时α-螺旋相对含量略有上升,可能在此时发生了结构重组,曲线拟合结果与去卷积结果基本吻合。引发重组的原因可能与蛋白降解或蛋白经一定程度酶解引起蛋白质结构、蛋白等电点和疏水性改变有关[33]。
| 图表编号 | XD0075150700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.25 |
| 作者 | 常荣、韦诚、段珍珍、周才琼 |
| 绘制单位 | 西南大学食品科学学院重庆市特色食品工程技术研究中心、西南大学食品科学学院重庆市特色食品工程技术研究中心、西南大学食品科学学院重庆市特色食品工程技术研究中心、西南大学食品科学学院重庆市特色食品工程技术研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式