《表4 捻转制作过程中三种样品蛋白质二级结构含量》
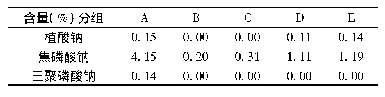
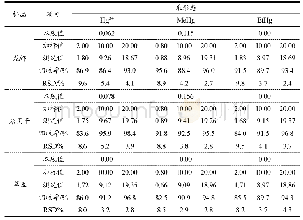
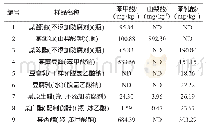
速冻青麦仁、烤制青麦仁及成品捻转的红外光谱图见图2。图2表示三种样品在500~4000 cm-1波段拟合特征曲线图,比较捻转制作过程中三个样品的红外光谱图,可知3个样品红外光谱整体相似,波数位置也较为接近,吸收峰的走向趋势基本一致但不完全重合,这表明其内含成分的组成基本一致,但各物质的含量存在差异[25,26]。由图2可知,碳水化合物-OH伸缩振动对应3600~3300 cm-1范围,-CH2-伸缩振动对应2926.45 cm-1吸收峰,酰胺I(C=O)波数对应于1700~1600 cm-1范围。青麦仁蛋白与小麦蛋白所含二级结构一样,都包含所含α-螺旋、β-折叠、β-转角和无规则卷曲[27]。利用Omnic 8.2和Peakfit 4.12软件对图2进行计算,由表5可知,捻转制作过程中,蛋白的吸收峰发生了偏移,二级结构含量组成也发生变化,这说明烤制和碾压对分离蛋白的二级结构都有不同程度的影响。经烤制和碾压加工后,α-螺旋、β-折叠的含量分别减少了5.60%和3.67%,其中α-螺旋结构含量下降明显(p<0.05),α-螺旋结构与面筋蛋白网络结构形成密切相关,α-螺旋结构含量下降表明面筋蛋白网络结构弱化,制作的捻转弹性减弱。捻转中β-转角和无规则卷曲结构的含量分别增加了3.80%和6.57%,研究表明[28]样品蛋白经过挤压热处理后,蛋白质间的疏水相互作用导致蛋白质发生聚集,从而导致蛋白质结构发生变化。Mills[29]研究也发现热处理会导致蛋白质二级结构中的β-折叠含量的下降。捻转制作过程中蛋白质二级结构的变化也说明碾压和烘烤处理会导致制作过程中捻转蛋白分子构象发生改变,形成新的稳定状态,从而影响捻转的品质。
| 图表编号 | XD00157534100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.05.20 |
| 作者 | 张康逸、康志敏、王莉、赵迪、郭东旭、张萌丽、宋江峰 |
| 绘制单位 | 河南省农业科学院农副产品加工研究中心、河南省农业科学院农副产品加工研究中心、江南大学食品学院粮食发酵工艺与技术国家工程实验室、河南省农业科学院农副产品加工研究中心、河南省农业科学院农副产品加工研究中心、河南省农业科学院农副产品加工研究中心、江苏省农业科学院农产品加工研究所 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式