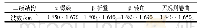《表4 经过不同加工阶段后大豆蛋白中酰胺I带中不同峰的位置、含量及二级结构归属》
为了更加明确地表示大豆蛋白在加工操作过程中二级结构的变化,根据文献[24-25]分别对酰胺I带去卷积后高斯曲线拟合图谱中各个峰进行指纹识别。如表4所示,未经处理的大豆蛋白的二级结构以β-折叠为主,其含量可以达到46.36%,其余依次为β-转角(18.48%)和无规卷曲(15.45%),含量最低的为α-螺旋,仅为11.27%左右,这与Li Huijing等的结论[26]相似,显示出大豆蛋白较为紧密的结构。大豆经过浸泡、磨浆加工后得到生浆,从生浆中蛋白的二级结构可以发现,1 631 cm-1(β-折叠)和1 685 cm-1(反平行β-折叠)两处峰消失,导致了β-折叠含量从46.36%下降到40.38%;与此同时,α-螺旋和β-转角的含量增加。Georget等的研究发现,蛋白质在不同水分含量的体系下,由于大量氢键的存在会导致其二级结构中β-折叠含量下降[27]。同时,在磨浆的过程中,物理破碎和挤压同样对大豆蛋白的结构造成一定的破坏,这样就造成了生浆中蛋白质由收缩的紧密结构逐渐呈现为展开状态。与生浆相比,熟浆中β-折叠含量又呈现上升趋势,尤其是在1 632 cm-1处峰的出现导致β-折叠含量上升至44.21%。这主要是由于豆浆中7S球蛋白的变性温度为(70±2)℃,11S球蛋白的变性温度为(90±2)℃[28],而煮浆的温度要超过蛋白质的变性温度;变性后大豆蛋白的空间结构进一步展开,随着分子间次级键和共价键的作用,容易导致蛋白质发生聚集,这就是大豆蛋白的热聚集行为[29]。也有学者发现在加热的状态下,11S球蛋白的碱基亚基和7S球蛋白的β-亚基以及少量的α、α’亚基之间发生相互作用,二硫键是聚集体形成的主要作用力[30],从而影响蛋白质的二级结构。
| 图表编号 | XD0041223500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.15 |
| 作者 | 赵雷、朱杰、苏恩谊、杨浩文、胡卓炎、李琳 |
| 绘制单位 | 华南农业大学食品学院、东莞理工学院化学工程与能源技术学院、华南农业大学食品学院、华南农业大学食品学院、华南农业大学食品学院、东莞理工学院化学工程与能源技术学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式