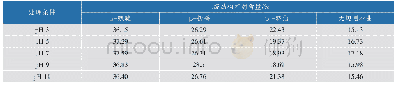
《表4 利用酰胺I带拟合米糠清蛋白二级结构结果》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《pH值对米糠清蛋白和球蛋白的结构、溶解性及表面疏水性的影响》
%
米糠蛋白的二级结构组成主要由酰胺I带确定,酰胺I带拉曼特征峰位置为:α-螺旋1 645~1 660 cm-1;β-折叠1 665~1 680 cm-1;β-转角1 680~1 690 cm-1;无规卷曲1 660~1 670 cm-1[32-33]。由表4、5基于拉曼光谱酰胺I带拟合分析得出的米糠球蛋白及清蛋白二级结构结果可以看出,在所测范围内,随着pH值的增大,米糠球蛋白α-螺旋及β-转角含量均无显著变化(P>0.05),而β-折叠含量降低趋势,无规卷曲含量呈增大趋势。与CD的结果相比有所差异,这种构象的转变可能与碱性条件下亚基解离有关。
| 图表编号 | XD00225594100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.25 |
| 作者 | 杨健、富天昕、张舒、冯玉超、王长远 |
| 绘制单位 | 国家杂粮工程技术研究中心、黑龙江八一农垦大学食品学院、黑龙江八一农垦大学食品学院、黑龙江八一农垦大学食品学院、国家杂粮工程技术研究中心、黑龙江八一农垦大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |