《表2 鸡蛋清粉酰胺I带二级结构组成比例》
单位:%
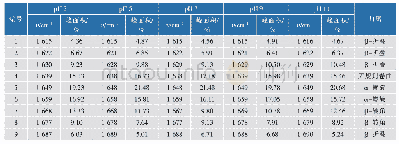
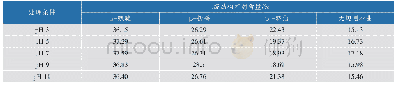
如图3所示,不同干燥方式下蛋清粉在3 700~3 200 cm-1位置的峰强度存在很大差异(SD>HD>FD),表明干燥方式会影响蛋清蛋白的水合能力。这可能是蛋白质分子中N—H伸缩振动与氢键形成了缔合体,或者蛋白分子与葡萄糖以共价键分子结合导致吸收强度增大所致[23]。1 700~1 600 cm-1的波长范围为酰胺I带,其不仅与氢键作用力紧密相关,而且影响蛋清粉蛋白质的二级结构;3种样品均在酰胺I带出现了特征吸收现象,而O—H或N—H与CO之间形成的氢键比O—H自身形成的作用大。FD蛋清粉在酰胺I带处的峰位于1 651.72 cm-1,HD与SD处理样品分别红移到1 651.22、1 650.48 cm-1,说明较高温度的干燥条件使N—H与CO形成的氢键总量增加,使峰位发生改变[24];蛋清蛋白中C—H伸缩振动的强吸收峰一般在2 959.84 cm-1处,而HD和SD蛋清粉的吸收峰移至2 961.64、2 962.57 cm-1,可能是由于干燥温度改变了蛋白质分子间的介电常数,对疏水侧链产生了影响。如表2所示,3种样品酰胺I带的二级结构中SD和HD的α-螺旋结构比例较FD分别降低了51.84%和24.58%,与凝胶硬度成反比,说明干燥方式可以改变蛋白二级结构,进而改善凝胶性。前人研究表明蛋清蛋白中α-螺旋含量最多约为40%[25],α-螺旋结构是蛋白质分子内的有序排列,通过分子内氢键维持。HEMUNG等[26]报道了蛋白α-螺旋含量与凝胶硬度之间呈负相关;干燥温度增加时α-螺旋结构的氢键作用减弱,使蛋白质分子展开程度增加,同时,蛋白质内部疏水基团暴露,使蛋白质表面巯基含量增加,进而造成蛋白凝胶硬度增大,与本研究结果一致。此外SD中β-转角含量增加最大,其结构的增加可能是由其他有序结构单元转化而来,孙佳悦等[27]发现干燥温度增加促进了蛋清蛋白热聚集体的形成,且β-转角结构在热聚集体的形成过程中具有重要作用。蛋白质热聚集体的形成对蛋白质凝胶性有促进作用,因此,SD蛋清粉的凝胶硬度更大。
| 图表编号 | XD00111404000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.10.15 |
| 作者 | 代晓凝、刘丽莉、陈珂、李媛媛、郝威铭、杨晓盼 |
| 绘制单位 | 河南科技大学食品与生物工程学院、食品加工与安全国家级教学示范中心(河南科技大学)、河南科技大学食品与生物工程学院、食品加工与安全国家级教学示范中心(河南科技大学)、河南科技大学食品与生物工程学院、食品加工与安全国家级教学示范中心(河南科技大学)、河南科技大学食品与生物工程学院、食品加工与安全国家级教学示范中心(河南科技大学)、河南科技大学食品与生物工程学院、食品加工与安全国家级教学示范中心(河南科技大学)、河南科技大学食品与生物工程学院、食品加工与安全国家级教学示范中心(河南科技大学) |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式