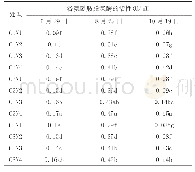
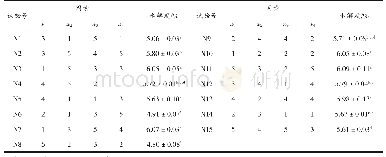
《表2 超声-转谷氨酰胺酶处理的RBPI二级结构含量》
对FTIR光谱中的酰胺I带进行去卷积,然后进行二阶导数拟合,得到各子峰所对应的归属:1 650~1 660 cm-1为α-螺旋,1 618~1 640 cm-1和1670~1690 cm-1为β-折叠,1 660~1 670 cm-1和1 690~1 700 cm-1为β-转角,1 640~1 650 cm-1为无规卷曲[31]。通过峰面积计算得到各二级结构的含量,结果见表2。超声处理5 min后RBPI的α-螺旋和β-转角含量显著降低(P<0.05),无规卷曲含量显著增加(P<0.05),β-折叠含量变化不显著(P>0.05),这说明超声处理能够降低蛋白质二级结构的有序性,使二级结构变得更加无序。Hu Hao等[21]采用功率为200 W的超声处理大豆蛋白15 min,导致二级结构发生显著改变,无序结构含量大幅上升,这与本研究结果一致。与未经处理的RBPI相比,TG处理会导致RBPI的α-螺旋和无规卷曲含量显著降低(P<0.05),β-结构(β-折叠和β-转角)含量显著增加(P<0.05)。这可能是由于TG催化的酰基反应破坏了使α-螺旋结构规则排布的氢键的稳定性,而展开的多肽链暴露出更多的氢键以及疏水基团重新排列,导致在分子聚集过程中重新连接形成β-结构[32]。由此可以推断,TG处理后使RBPI分子二级结构变得更加有序,这也与TG催化蛋白质交联形成聚集体有关[33]。此外,超声5 min与TG联合处理会使更多的无规卷曲结构转变为β-折叠结构,这表明超声-TG联合处理能够促进蛋白质交联,是修饰蛋白质二级结构的有效手段。RBPI功能性质的改善可能与蛋白质二级结构的这种变化有关。
| 图表编号 | XD00106038100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.10.15 |
| 作者 | 赵城彬、尹欢欢、刘景圣、许秀颖、张浩、吴玉柱、曹勇、齐宝坤、吴非 |
| 绘制单位 | 吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、吉林农业大学食品科学与工程学院小麦和玉米深加工国家工程实验室、东北农业大学食品学院、东北农业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式