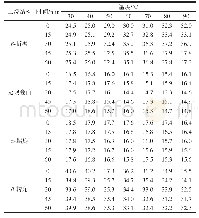
《表4 猪肌原纤维蛋白改性前后二级结构相对含量》
综合以上数据,得到对照组蛋白质二级结构相对含量为:α-螺旋51.90%、β-反平行30.72%、无规卷曲17.36%;超声波-TG复合改性组蛋白质二级结构相对含量分别为:α-螺旋16.75%、β-转角25.58%、β-平行18.59%、β-反平行24.08%、无规卷曲15.00%(表4)。改性处理对肌原纤维蛋白二级结构有显著影响,超声波-TG复合改性后蛋白质二级结构α-螺旋相对含量下降,β-折叠、β-转角相对含量升高,无规卷曲相对含量变化不明显。超声波处理使部分蛋白质长链发生断裂,肌原纤维蛋白的刚性结构减弱,柔性增强,二级结构发生一定的改变。超声波处理后增加了底物与TG的作用位点,催化蛋白质发生交联作用,生成大分子聚合物,增强蛋白质凝胶网络的稳定性,同时蛋白质二级结构发生改变,表现为β-折叠、β-转角相对含量升高。曹莹莹[27]、Choi[28]等的研究结果表明,当蛋白质二级结构中β-折叠相对含量较高时,其蛋白质的凝胶性以及持水性较高;当蛋白质二级结构中α-螺旋相对含量较高时,其蛋白质的凝胶性以及持水性较低。Li Ke等[29]的研究结果表明,利用超声波技术对蛋白质进行改性,可促使蛋白质二级结构α-螺旋相对含量降低、β-折叠与β-转角相对含量升高,同时亦证实超声波改性有利于增强蛋白质的凝胶强度以及持水性等。Liu Ru[30]、李鹏[31]等研究蛋白质的结构对猪肉、鸡肉、鱼肉凝胶特性的影响,结果发现β-折叠相对含量的升高有益于蛋白质凝胶性的提高。以上研究结果与本实验研究结果相似,说明超声波-TG改性可促使肌原纤维蛋白二级结构的改变,使α-螺旋构象向β-折叠、β-转角构象转变,二级结构的改变有利于提高肌原纤维蛋白的凝胶性。
| 图表编号 | XD00106037100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.10.15 |
| 作者 | 姜国川、王丽岩、刘亚春、孙洪蕊、张佳霖、刘学军、闫晓慧 |
| 绘制单位 | 吉林农业大学食品科学与工程学院、吉林农业大学食品科学与工程学院、吉林农业大学食品科学与工程学院、吉林省农业科学院农产品加工研究所、吉林省轻工业设计研究院、吉林农业大学食品科学与工程学院、吉林工商学院财税学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式