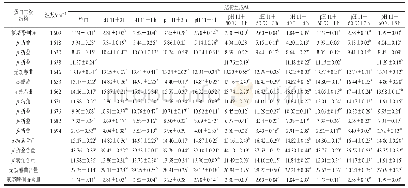
《表4 草鱼肌原纤维蛋白与腥味物质结合后二级结构的变化》
注:同行肩标小写字母不同表示差异显著(P<0.05)。
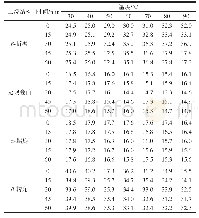
拉曼光谱检测是一种无损检测技术,受水分的影响较小,可作为判断物质分子结构的强有力的手段[22]。用拉曼光谱分析蛋白质,可以反映其肽链的骨架振动,侧链周围微观环境的变化及化学信息[23]。草鱼肌原纤维蛋白与腥味物质结合后归一化的拉曼光谱见图5,经Alix公式计算得出二级结构单元含量见表4。添加4种醛类物质后,α-螺旋结构降低,β-折叠和β-转角结构含量上升,这可能是由于肌球蛋白结构被破坏,蛋白质结构展开,α-螺旋结构转变成β-折叠和β-转角结构。其中添加己醛、庚醛、辛醛和壬醛后α-螺旋含量较对照组分别降低了15.66%,20.43%,20.97%和24.81%,表明蛋白质伸展暴露出更多的结合位点,更易与长链醛类物质结合。蛋白质二级和三级结构的稳定性大部分依靠非共价键力,如氢键、范德华力、静电相互作用和疏水相互作用,α-螺旋结构是稳定蛋白质最主要的结构[24],其中多肽链上羰基(-CO)和氨基(NH-)端之间的氢键是稳定α-螺旋的主要化学键,添加醛类物质破坏了稳定蛋白质结构的化学键,引起蛋白质变性。
| 图表编号 | XD00159691200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.31 |
| 作者 | 徐永霞、王瑞、赵佳美、周晓、李学鹏、仪淑敏、米红波、励建荣 |
| 绘制单位 | 渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心、西南大学食品科学学院、渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心、渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心、渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心、渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心、渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式