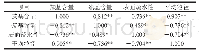
《表1·OH氧化对草鱼肌原纤维蛋白热稳定性的影响》
注:表格中数字肩标同一列不同小写字母表示差异具有显著性(P<0.05)
蛋白质吸热变性是热聚集行为的基础,热变性程度的难易与蛋白质的热稳定性密切相关,蛋白质稳定性越高,热变性相对越难发生。在DSC图谱中,最高峰对应的温度为蛋白变性温度,该温度越高表明蛋白质越稳定;ΔH代表蛋白变性焓值,该值越大则表明蛋白质越不容易发生变性,稳定性越高[21]。肌原纤维蛋白主要有肌球蛋白和肌动蛋白组成,因此DSC图谱中常出现2个变性峰,同时肌球蛋白的变性温度比肌动蛋白低,第一个峰为肌球蛋白热变性温度,第二个峰则为肌动蛋白的热变性温度[21]。本研究中得到的DSC图谱中肌球蛋白有明显的变性峰,肌动蛋白的变性峰则不太明显,可能是与蛋白来源及处理方法有关。由于肌球蛋白是肌原纤维蛋白热聚集和凝胶的主要影响因素,因此本研究主要分析了肌球蛋白的变性情况。·OH氧化后草鱼肌原纤维蛋白经DSC分析得到的肌球蛋白的热稳定性参数起始温度、转变温度及ΔH的变化如表1所示。对照组(0 mmol/L H2O2组)样品热转变温度为55.57℃,与报道的梅鱼肌球蛋白的最大热变性温度(55.69℃)较一致[21]。0.1~10 mmol/L H2O2处理后肌球蛋白的热转变温度较明显高于对照组。0.1~1 mmol/L H2O2处理组的ΔH值高于对照组,10 mmol/L H2O2处理组低于对照组。这说明较低浓度·OH氧化使草鱼肌球蛋白的热稳定性增强,而高浓度·OH氧化使蛋白热稳定性下降。其原因可能是较低浓度时·OH氧化产生二硫键等作用增强了分子间作用力,促进蛋白质分子交联[14,22-23],提高了热稳定性;高浓度·OH氧化会破坏肌球蛋白结构,使蛋白发生去折叠反应,从而导致热稳定性下降[24]。LIU等[25]发现·OH氧化引起的肌球蛋白有序的二级结构含量的变化与ΔH相关,同时·OH氧化可以修饰许多带电荷的氨基酸残基(组氨酸、赖氨酸和精氨酸),这种修饰可能影响蛋白质总电荷量及电荷分布情况,从而导致蛋白质稳定性改变。
| 图表编号 | XD00170954000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.05.25 |
| 作者 | 李学鹏、蔺博燕、王金厢、周明言、朱文慧、仪淑敏、励建荣、林洪、牟伟丽、郭晓华 |
| 绘制单位 | 渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心国家鱼糜及鱼糜制品加工技术研发分中心、渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心国家鱼糜及鱼糜制品加工技术研发分中心、渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心国家鱼糜及鱼糜制品加工技术研发分中心、渤海大学食品科学与工程学院生鲜农产品贮藏加工及安全控制技术国家地方联合工程研究中心国家鱼糜及鱼糜制品加工技术研发分中心、渤海大学食品科学与工程学院生鲜 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式