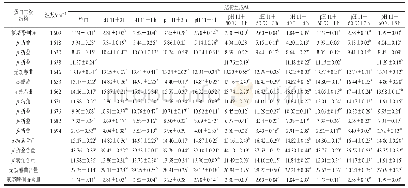
《表1 p H值碱性偏移结合热处理对米糠蛋白二级结构的影响》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《pH值碱性偏移结合热处理对米糠蛋白结构和功能性质的影响》
注:同行不同肩标小写字母表示差异显著,P<0.05。—.未检出。
傅里叶变换红外光谱是分析蛋白质结构变化的主要技术之一,特别是酰胺I带(1 700~1 600 cm-1),是表征蛋白质二级结构最常用的特征频率区域[19]。蛋白质二级结构变化会影响其表面疏水性和柔性,进而影响功能性质[20]。参考Sun Weizheng等[21]的方法对p H 11偏移以及结合热处理的米糠蛋白去卷积酰胺I带吸收光谱进行Gaussian拟合,得到11个特征吸收峰(表1)。1 609 cm-1是由氨基酸侧链(尤其是酪氨酸残基等)产生的特征吸收峰[21]。1 610~1 628 cm-1的特征吸收峰通常被认为是β-折叠平行排列产生的,而1 630~1 640 cm-1和1 675~1 695 cm-1的特征吸收峰则被认为是β-折叠反平行排列产生的[22]。1 653 cm-1的强吸收峰是α-螺旋结构的C=O伸缩振动产生的[21,23]。1 671 cm-1的特征吸收峰可归属于β-转角结构,而1 646 cm-1和1 662 cm-1的特征吸收峰被认为是无规卷曲结构产生的[24]。结果显示,相比于未处理的米糠蛋白,p H 11偏移处理使得米糠蛋白β-折叠含量明显降低,α-螺旋含量略微降低,无规卷曲、β-转角和氨基酸侧链结构含量有所增加。p H值会改变蛋白表面带电氨基酸、α-羰基和α-氨基末端质子化状态,影响蛋白质分子结构的稳定性,促使蛋白质分子展开,这可能是导致米糠蛋白二级结构从有序向无序转化的主要原因[25]。相比于p H值碱性偏移处理,p H值碱性偏移结合热处理1 h的米糠蛋白β-折叠含量显著升高(P<0.05),无规卷曲和β-转角的含量显著降低(P<0.05);当加热时间延长到3 h时,米糠蛋白β-折叠含量显著降低(P<0.05),无规卷曲和β-转角的含量显著升高(P<0.05);当加热时间延长到5 h时,米糠蛋白β-折叠含量增加到44%左右,无规卷曲和β-转角的含量又随之下降。在蛋白质处于极端碱性环境中,由于碱的作用使蛋白质分子展开,暴露出蛋白质内部的疏水基团,暴露出来的疏水基团又因为相互作用而聚集;当蛋白质处于加热环境中时,温度升高导致蛋白质分子展开,然后通过疏水作用、氢键、二硫键等相互作用而聚集[26]。因而,p H 11偏移结合热处理时,米糠蛋白的二级结构呈现折叠-去折叠-复折叠的复杂变化过程。
| 图表编号 | XD00209424400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.02.25 |
| 作者 | 吴晓娟、王晓婵、张佳妮、沈佳丽、李依、金曼芹、吴伟 |
| 绘制单位 | 中南林业科技大学食品科学与工程学院稻谷及副产物深加工国家工程实验室、中南林业科技大学食品科学与工程学院稻谷及副产物深加工国家工程实验室、中南林业科技大学食品科学与工程学院稻谷及副产物深加工国家工程实验室、中南林业科技大学食品科学与工程学院稻谷及副产物深加工国家工程实验室、中南林业科技大学食品科学与工程学院稻谷及副产物深加工国家工程实验室、中南林业科技大学食品科学与工程学院稻谷及副产物深加工国家工程实验室、中南林业科技大学食品科学与工程学院稻谷及副产物深加工国家工程实验室 |
| 更多格式 | 高清、无水印(增值服务) |





