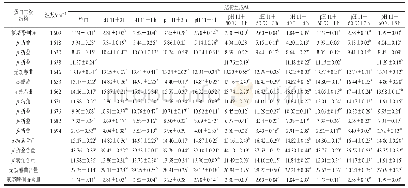
《表3 超声预处理对蛋白二级结构的影响》
傅里叶变换红外光谱是表征蛋白质二级结构的主要技术方法之一。热处理可断开蛋白α-螺旋结构中的氢键,使α-螺旋结构减少[30],β-转角结构和β-折叠结构(β1+β2)含量增多。而反向平行的折叠结构(β1)通常在聚集的蛋白质分子间形成[31],在一定程度上可表征蛋白的聚集程度。如图3和表3所示,与SSPI相比,STSPI的β1结构增多,α-螺旋和γ-无规则卷曲结构均减少;随着超声功率的增大,β1呈现减小趋势,α-螺旋和γ-无规则卷曲结构增多;与6 min 600 W-STSPI相比,随着超声时间的增大,β1增多,α-螺旋、β-转角和γ-无规则卷曲结构均减少。
| 图表编号 | XD00167925900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.25 |
| 作者 | 李杨、陈凡凡、王中江、滕飞 |
| 绘制单位 | 东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式