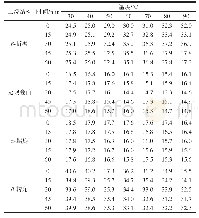
《表2 滚揉处理对鸭肉蛋白质二级结构相对含量的影响(%)》
注:同列不同小写字母表示差异显著(P<0.05)。
酰胺Ⅰ带(1 600~1 700 cm-1)是反映蛋白质二级结构的主要谱带[6,23],α-螺旋结构特征峰主要集中在1 645~1 657 cm-1范围内;β-折叠结构特征峰主要在1 665~1 680 cm-1;β-转角结构主要在1 680 cm-1附近;无规则卷曲结构主要在1 660~1 665 cm-1附近[18,24]。本研究对鸭肉进行不同滚揉腌制处理,对处理后鸭肉肌原纤维蛋白的二级结构组成及含量进行分析,结果如表2所示,可以看出滚揉处理对蛋白质的二级结构的相对含量产生显著影响(P<0.05)。未经滚揉的鸭肉中α-螺旋结构含量最高,可达75.79%,而β-折叠、β-转角和无规则卷曲相对较低;经过真空滚揉和超声波辅助变压滚揉处理100 min后,α-螺旋结构分别降至39.09%和21.75%,而β-折叠、β-转角和无规则卷曲结构的含量显著增大(P<0.05),其中超声波辅助变压滚揉样品各结构含量变化最大,该结果表明滚揉处理能够引起蛋白质结构的变化。原因可能是超声波辅助变压滚揉通过物理破坏和超声的空化效应导致蛋白质α-螺旋结构的破坏或者部分α-螺旋结构转化为其它结构,从而影响鸭肉的相关加工特性[6,19]。
| 图表编号 | XD00113991700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.10.31 |
| 作者 | 李鹏、孙京新、冯婷、王淑玲、黄明、徐幸莲、周兴虎 |
| 绘制单位 | 青岛农业大学食品科学与工程学院、青岛农业大学食品科学与工程学院、青岛农业大学食品科学与工程学院、青岛农业大学食品科学与工程学院、南京农业大学国家肉品质量安全控制工程技术研究中心、南京农业大学国家肉品质量安全控制工程技术研究中心、南京农大肉类食品有限公司 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式