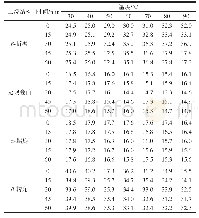
《表2 肌球蛋白二级结构相对含量变化》
肌球蛋白在加工过程中二级结构相对含量的变化如表2所示,天然肌球蛋白的β-折叠、无规则卷曲、α-螺旋和β-转角含量分别为16.22%、22.11%、25.31%和36.36%,漂洗后β-折叠和无规则卷曲含量略微减少,α-螺旋略增加,β-转角无明显变化,这与袁凯等关于对白鲢鱼糜的二级结构研究结果类似[33]。斩拌鱼糜肌球蛋白无规则卷曲结构相对含量降低了4%,而β-折叠和β-转角分别增加3%和2%,而李贤[25]通过对鲢鱼肌球蛋白二级结构研究发现,随着斩拌或者擂溃的进行,α-螺旋解折叠展开转变为无规则卷曲,这可能与斩拌时间、斩拌温度以及鱼种等有一定的关系。在30~90℃,随着加热温度的升高,肌球蛋白二级结构中β-折叠含量逐渐升高,α-螺旋含量逐渐减少。无规则卷曲在低于40℃加热含量无明显变化,而在高于50℃加热时,无规则卷曲结构含量显著下降。β-转角在70℃以下加热,含量无明显变化,在70~90℃温度范围内,其含量明显下降。α-螺旋是紧密而无空腔的结构,结构过于稳定,不利于功能特性所需要的某种构象变化,β-结构和无规则卷曲也是紧密有序的稳定结构,但是相比α-螺旋结构他们的紧密程度和构象稳定性明显变差,但是蛋白质的柔韧条件明显改善,更加有利于发挥蛋白质的某种功能特性[34]。通常加热条件下α-螺旋含量降低代表蛋白质分子展开程度增加,而β-折叠含量增加代表蛋白质分子间聚集程度增加,β-结构的形成是凝胶形成的基础,两者含量的增高有利于良好凝胶结构的形成[35]。此可以推测在低温加热条件下,对蛋白质凝胶结构起稳定作用的主要是β-转角,而在高温条件下主要是β-折叠起稳定作用,贾丹[36]同样发现鲢鱼肌球蛋白二级结构中β-折叠在温度高于50℃才开始形成。由此可见,蛋白质二级结构中β-结构的变化是形成凝胶的前提。
| 图表编号 | XD00170976000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.25 |
| 作者 | 刘芳芳、林婉玲、李来好、吴燕燕、杨少玲、黄卉、杨贤庆 |
| 绘制单位 | 中国水产科学研究院南海水产研究所国家水产品加工技术研发中心农业农村部水产品加工重点实验室、上海海洋大学食品学院、中国水产科学研究院南海水产研究所国家水产品加工技术研发中心农业农村部水产品加工重点实验室、韩山师范学院食品工程与生物科技学院、中国水产科学研究院南海水产研究所国家水产品加工技术研发中心农业农村部水产品加工重点实验室、中国水产科学研究院南海水产研究所国家水产品加工技术研发中心农业农村部水产品加工重点实验室、中国水产科学研究院南海水产研究所国家水产品加工技术研发中心农业农村部水产品加工重点实验室、中 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式