《表1 肌球蛋白红外光谱特征吸收峰的波数》
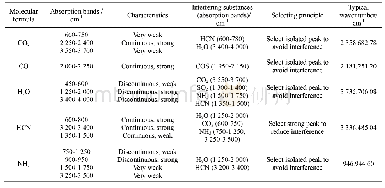
蛋白质在红外区有多个吸收带,不同处理条件下肌球蛋白的红外吸收峰如表1示。由表1可知,原料肌球蛋白酰胺A、酰胺B、酰胺I、酰胺Ⅱ和酰胺III吸收峰的波数分别为3 304.06 cm-1、2 929.87 cm-1、1 664.57 cm-1、1 539.20 cm-1和1 247.94 cm-1,酰胺A区的吸收峰在3 440~3 400 cm-1处,主要指N—H的收缩振动,与氢键的形成有关,并且当含N—H基团的肽段参与氢键形成时,N—H基团的伸缩振动产生的吸收峰会降低100 cm-1左右,从而使吸收峰出现在3 340~3 300 cm-1[30],因此可以推测肌球蛋白在不同处理条件下均有氢键的存在。酰胺B区指C—H的伸缩振动,经过漂洗后发生蓝移,斩拌后发生红移,加热对酰胺B区无影响。酰胺Ⅰ、Ⅱ和Ⅲ带是反映蛋白质肽链骨架结构的最重要吸收峰[31],酰胺Ⅱ吸收峰出现在1 600~1 500 cm-1,主要指C—N伸缩振动和N—H变形振动,酰胺Ⅰ带吸收峰是由蛋白多肽骨架的伸缩振动而引起,主要指CO伸缩振动,甘氨酸和脯氨酸残基的—CH2特征振动峰为酰胺Ⅲ,酰胺III带的波数为1 220~1 330 cm-1,酰胺Ⅰ带和酰胺Ⅲ带常被用来指认蛋白质的二级结构,但酰胺Ⅲ带吸收峰强度低,因此通常利用酰胺Ⅰ带分析蛋白质二级结构。酰胺Ⅰ带与蛋白肽链骨架的有序程度紧密相关,一般来说,酰胺Ⅰ带吸收峰波数越大,蛋白质结构有序度越高[32]。由表1可知,漂洗后波数增大,而斩拌后发生红移,波数较少,这可能是斩拌造成蛋白质α-螺旋解旋导致,随着加热温度的升高,酰胺Ⅰ带发生蓝移,波数增加,蛋白质结构越紧密,因此为进一步研究肌球蛋白在加工过程中二级结构的变化,本实验中通过二阶导、高斯拟合处理酰胺Ⅰ带研究肌球蛋白二级结构相对含量的变化。
| 图表编号 | XD00170976100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.25 |
| 作者 | 刘芳芳、林婉玲、李来好、吴燕燕、杨少玲、黄卉、杨贤庆 |
| 绘制单位 | 中国水产科学研究院南海水产研究所国家水产品加工技术研发中心农业农村部水产品加工重点实验室、上海海洋大学食品学院、中国水产科学研究院南海水产研究所国家水产品加工技术研发中心农业农村部水产品加工重点实验室、韩山师范学院食品工程与生物科技学院、中国水产科学研究院南海水产研究所国家水产品加工技术研发中心农业农村部水产品加工重点实验室、中国水产科学研究院南海水产研究所国家水产品加工技术研发中心农业农村部水产品加工重点实验室、中国水产科学研究院南海水产研究所国家水产品加工技术研发中心农业农村部水产品加工重点实验室、中 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
![表2 土壤有机质红外光谱特征吸收峰的归属[9,43]](http://bookimg.mtoou.info/tubiao/gif/TURA202006001_02400.gif)