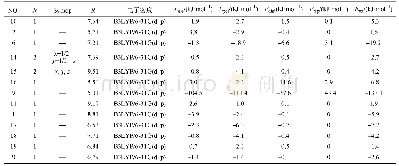
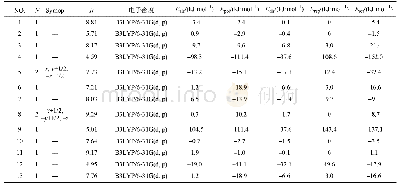
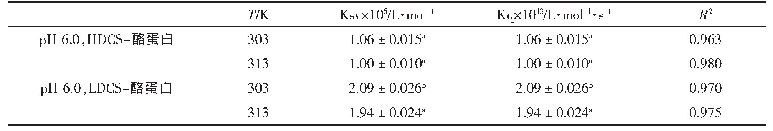《表1 蛋白质分子相互作用力在酸肉发酵中的变化》
注:数据以±s表示,n=3;大写字母不同表示同行数据差异显著(P<0.05);小写字母不同表示同列数据差异显著(P<0.05);S1和S2.分别表示肌原纤维蛋白和肌浆蛋白质三级结构中的静电相互作用;S3.氢键;S4.疏水相互作用;S5.二硫键。下同。
本实验采用5种不同的溶剂规避不同的蛋白质相互作用力,其中KCl、SDS、尿素分别能够规避静电作用力、氢键、疏水作用力,而巯基乙醇则能够打破二硫键,因此蛋白质在S1、S3、S4、S5中的溶解量分别表示静电相互作用、氢键、疏水相互作用及二硫键对蛋白三级结构的贡献,结果见表1。发酵0 d时,S3>S4>S5>S1>S2,说明猪肉蛋白天然结构由氢键、疏水相互作用力、静电相互作用力及二硫键共同维系;从量的角度看,主要是氢键和疏水相互作用。发酵后这几种作用力对蛋白三维结构的贡献发生了改变。随发酵时间延长,蛋白质在S1和S2中的溶解度逐渐下降,180 d时,蛋白溶解度分别为发酵0 d时的24.96%和26.57%,可能是发酵产酸等诱发蛋白质天然结构改变,导致其发生变性聚集,进而引起蛋白盐溶性下降。S3在发酵中逐渐增加,50 d后保持稳定略降,推测蛋白分子间氢键在发酵中不断破坏又重新合成。S4和S5在发酵20 d快速增加后波动变化,均明显高于0 d的溶解度,说明经发酵后蛋白疏水相互作用明显增强,从而引起蛋白分子构象发生改变和蛋白聚集,此时,酸诱导蛋白的变性利于蛋白分子展开,使埋藏在分子内部的巯基外露被氧化成二硫键。另外,发酵20~80 d时S4>S5>S3,之后变为S5>S4>S3,表明二硫键在发酵80 d后的酸肉蛋白三维结构中起主导作用。S3~S5未呈规律性较强的变化,可能与发酵后形成非二硫共价键或参与了蛋白三维结构等有关[17]。这些改变对酸肉蛋白凝胶结构的形成和稳定性产生重要影响,可影响酸肉感官品质和营养特性。
| 图表编号 | XD0075150600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.25 |
| 作者 | 常荣、韦诚、段珍珍、周才琼 |
| 绘制单位 | 西南大学食品科学学院重庆市特色食品工程技术研究中心、西南大学食品科学学院重庆市特色食品工程技术研究中心、西南大学食品科学学院重庆市特色食品工程技术研究中心、西南大学食品科学学院重庆市特色食品工程技术研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式