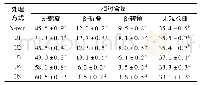
《表1 不同水解度大米蛋白的二级结构》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《限制性酶解对大米蛋白结构、功能特性及体外抗氧化活性的影响》
注:结果表示为平均值±方差,字母相异表示差异性显著(P<0.05)。
红外光谱中1 600~1 700 cm-1是蛋白质的酰胺I区,通常可通过去卷积峰形拟合得到蛋白的二级结构信息,结果见表1。相比于天然大米蛋白(DH0),酶解物中的α-螺旋和β-折叠的含量均有所降低,而β-转角的含量显著增加。随着酶解程度的增大这一变化更加明显,说明在酶解过程中蛋白质结构展开,有序的β-折叠结构被破坏,转变为更加灵活舒展的β-转角结构。同时伴随着分子内更强的氢键作用,这种结构有助于蛋白分子紧密吸附于油水界面上,具备更好的乳化性能[25]。Yong等[26]利用谷氨酰胺酶处理麦谷蛋白后麦谷蛋白的二级结构更加灵活,同时也伴随着β-折叠含量降低,β-转角含量增加的现象。
| 图表编号 | XD00201333500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.30 |
| 作者 | 马晓雨、陈先鑫、胡振瀛、朱雪梅、熊华、赵强 |
| 绘制单位 | 南昌大学食品科学与技术国家重点实验室、山东科技大学泰山科技学院、江西卫生职业学院、南昌大学食品科学与技术国家重点实验室、南昌大学食品科学与技术国家重点实验室、大连工业大学食品学院、南昌大学食品科学与技术国家重点实验室、南昌大学食品科学与技术国家重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |