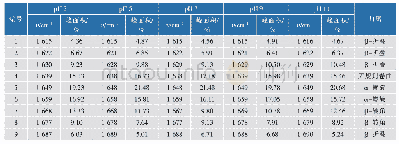
《表2 不同高压均质下的SPI和SPI-SI二级结构相对含量》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《高压均质对大豆分离蛋白-大豆异黄酮相互作用及其复合物功能性质的影响》
注:同列肩标小写字母不同表示有显著性差异(P<0.05)。
蛋白质的红外光谱拥有多个特征吸收谱区域组成,其中酰胺I区波数范围是1 600~1 700 cm-1。主要由C=O伸缩振动引起,其主要对蛋白质的二级结构敏感[20]。高压均质处理后,SPI的FTIR光谱图如图4所示,FTIR光谱可以灵敏地反映肽链结构的变化。根据FTIR数据拟合过程的蛋白质二级结构的变化如表2所示。从40 MPa升高到80 MPa时,α-螺旋相对含量降低(HP-7和HP-8除外),β-转角和无规卷曲相对含量显著下降,β-折叠相对含量逐渐升高。α-螺旋是蛋白质结构中最稳定的结构,其含量降低表明适宜的高压均质压力可以改变蛋白质的二级结构,蛋白质的空间结构变得更加拉伸,可能会影响SPI与其他物质的结合程度。据报道,β-折叠含量的增加表明负责疏水相互作用的蛋白质位点暴露,从而导致蛋白质表面疏水性的增强[21],这在蛋白质表面疏水性分析中得到进一步证实。但在120 MPa下,呈现α-螺旋含量升高(HP-7和HP-8除外),β-转角含量显著上升。这种现象表明高压均质处理处理改变了SPI的氢键,导致不同二级结构之间的转化。
| 图表编号 | XD00225602300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.15 |
| 作者 | 王娜、吴长玲、陈凡凡、李杨、滕飞 |
| 绘制单位 | 东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |