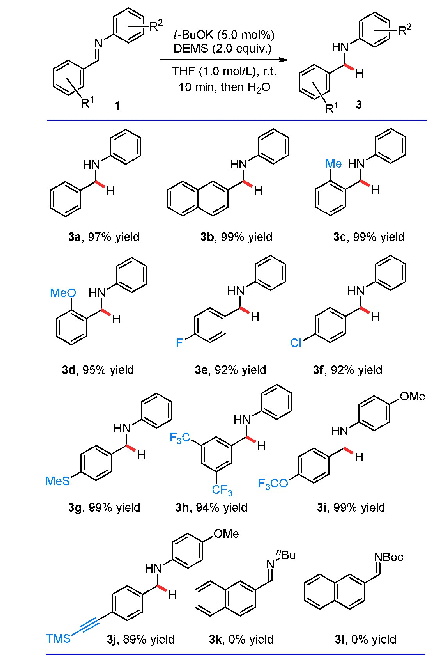
《表2 反应底物拓展a,b》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《"三苯基膦催化下联烯丁酸酯与橙酮的陆氏[3+2]环化反应研究:制备螺[1-苯并呋喃-3-酮-2,5'-环戊烯]类化合物"》
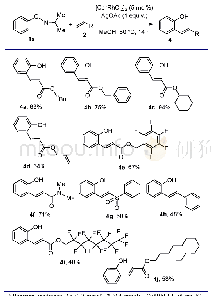
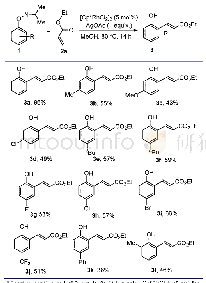
在获得该反应最优反应条件后,反应底物的适用性研究随即进行(表2).首先研究了底物橙酮类化合物R1基团对反应的影响.先选定底物R1基团为取代苯基,R2为氢时,研究不同取代苯基基团对反应产率及区域选择性的影响(表2,3a~3g).通过实验结果可知,橙酮上R1为对位拉电子基团取代的苯基及对位甲基取代的苯基时,反应底物1b~1d及1e,在优化的反应条件下都能与联烯酸酯2a顺利反应.尽管反应的产率有些许地变化,但总体而言,反应都能以90%以上的分离总收率得到[3+2]环化产物.同时,就反应区域选择性而言,底物1b~1d得到的产物的区域选择性与模板底物的区域选择性相当,都是以γ-选择性产物为主,α-选择性产物为次,两者比例在2/1至3/1之间.这一结果表明R1作为各类取代苯基时,其对位上拉电子取代基对该反应的区域选择性影响不明显.然而,当此类取代基为甲基时(1e),该底物反应后不但得到了优异的环加成总产率(96%),且反应的区域选择性也有所提高(γ/α=5/1).基于此,又进一步对苯环对位与间位用甲氧基取代的橙酮1f和1g进行了考察.然而,这两个底物在反应24 h后,仍有原料剩余.即使增加联烯酸酯2a的用量也无法使反应完全进行.最终1f和1g只能得到70%左右的产率,且产物区域选择性也较之3e有所下降,分别为3.7/1与2.8/1.以上结果初步表明该[3+2]环化反应受底物影响较大.然后,又以R1为其它的芳基基团对橙酮的反应情况进行研究.由结果可知,R1基团无论是萘基(1h)、2-呋喃基(1i)或2-吡啶基(1j)的橙酮,它们与联烯丁酸酯反应时,都能完全转化,生成环化产物.值得一提的是,2-吡啶基取代的橙酮1j,在该反应过程中,尽管只得到了81%的产率,但仅为γ-选择性的产物.遗憾的是,尽管1h能在优化条件下得到环化产物,但同时有未确定结构且与α-选择性产物无法分离的化合物形成.接下来,又将R1基团换为脂肪烃类取代基,考察了底物的普适性.通过研究可知,R1基因为肉桂基(1k)、环己基(1m)或叔丁基(1n)时,反应均可进行,但反应时间较长,且产率降低严重.1k在反应中的区域选择性为1.5/1,γ-选择性为主.而1m与1n也只得到γ-选择性产物,并未观察到α-选择性产物.苯丙基取代的橙酮化合物1l在此反应条件下不反应,只回收了原料.研究了橙酮中R1基团后,接下来又对橙酮中的R2基团进行了研究.当R1为苯基,向橙酮的6-位或7-位分别引入了甲基,或向其5-位引入甲氧基(1o,1p,1q)时,联烯酸酯2a分别与橙酮1o与1p反应,能以不低于90%的产率得到相应的环化产物,其区域选择性仍以γ-选择性为主,比例分别为3.5/1与2.6/1.橙酮1q在相同的条件下反应,产率却只有73%,区域选择性比例为3q-γ/3q-α=3.8/1.对比applanatumin A分子结构,若要利用该策略对其进行合成,则橙酮的R1基团应考虑使用较大位阻的脂肪烃类取代基.因此,又开展了R1为叔丁基取代的橙酮化合物1r与1s在该反应条件下的适用性考察.通过反应研究可知,这两个橙酮化合物都能与2a发生相应的[3+2]环化得到螺环产物.尽管,它们的反应产率较低,却只得到γ-选择性产物.这一结果的获得,也为合成applanatumin A及其类似物提供了可能.随后,筛查了联烯酸酯化合物酯基对该环化反应的影响.在得到联烯丁酸苄酯2b与联烯丁酸叔丁酯2c后,使其分别与橙酮1a反应24 h后,2b只能以45%的产率生成γ-选择性的环化产物3t-γ.2c反应24 h后,以73%的总产率也得到了γ-选择性及α-选择性两种产物3u-γ与3u-α,其选择性比例为2.1/1.最后,橙酮中双键的立体构型对环化反应的影响也给予了初步的考察.当使用(E)-橙酮1v时,能与联烯酸酯2a发生环化反应.在反应12 h后,以57%的分离收率得到环化产物.然而,通过核磁鉴定可知,该反应只得到了α-选择性产物.与3a-α比较后,该环化产物被确认为非对映异构体3v-α.
| 图表编号 | XD009792700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.05.01 |
| 作者 | 苏瀛鹏、冯亚威、曹林丹、薛文轩、石娅、常兵兵、黄丹凤、王克虎、胡雨来 |
| 绘制单位 | 西北师范大学化学化工学院、西北师范大学化学化工学院、西北师范大学化学化工学院、西北师范大学化学化工学院、西北师范大学化学化工学院、西北师范大学化学化工学院、西北师范大学化学化工学院、西北师范大学化学化工学院、西北师范大学化学化工学院 |
| 更多格式 | 高清、无水印(增值服务) |