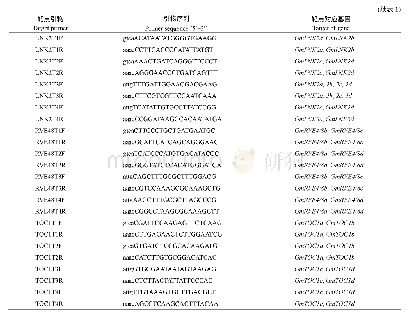
《表1 CRISPR/Cas9 sgRNA设计软件列表》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《CRISPR/Cas基因组编辑技术研究进展及其在植物中的应用》
CRISPR/Cas9系统是目前应用最为广泛的Cas类型,Cas9对不同靶点的切割效率差异很大。需要从多方面着手考虑Cas9的靶点设计:第一,精心进行靶点的筛选。Moreno-Mateos等(2015)发现靶点富集G而缺乏A可以增加sgRNA的稳定性和活性;Chari等(2015)在基于1 400个靶点和sgRNA的基础上开发了sgRNA的评分系统,并表明在离PAM位点-1位置处,G的偏好性强,T的偏好性差。此外,还有许多用于sgRNA效能预测和脱靶位点识别的软件工具(表1)。表1列出了这些工具的名称、主要特征和网址。第二,优化sgRNA骨架序列。Dang等(2015)特异性地将sgRNA延长了10个碱基,并将sgRNA中连续胸腺嘧啶中的第4个突变为胞嘧啶或鸟嘌呤,经过优化的sgRNA使得CRISPR/Cas9系统的敲除能力提高了将近50%。第三,优化sgRNA表达策略。Xie等(2015)利用内源性tRNA处理系统,通过精确地切割tRNA前体的两端提高CRISPR/Cas9系统的靶向性和多重编辑能力。第四,使用特异性启动子启动Cas9基因的表达。在水稻中,用Ubiquitin启动子显然比CaMV35S启动子效率高(Hu等2018b)。在拟南芥中,用CaMV35S启动Cas9基因在T1代只产生了嵌合体而没有纯合子或双等位基因突变(Feng等2013,2014)。然而,将卵细胞特异性启动子用于Cas9的转录翻译可以在T1代生成三突变体(Wang等2015c;Yan等2015;Mao等2016)。Feng等(2018)选择玉米减数分裂特异基因DMC1的启动子用于驱动Cas9基因的表达,能够在配子中实现高效的基因组编辑,T0代植株中获得60%~70%的纯合或双等位的突变体。这种突变能够稳定遗传到T1代,实现了玉米基因组的高效编辑。
| 图表编号 | XD0064040600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.04.20 |
| 作者 | 丁莉萍、张杰伟、马艳、陈亚娟、王宏芝、魏建华 |
| 绘制单位 | 北京市农林科学院北京农业生物技术研究中心农业基因资源与生物技术北京市重点实验室、北京市农林科学院北京农业生物技术研究中心农业基因资源与生物技术北京市重点实验室、金陵科技学院园艺园林学院、北京市农林科学院北京农业生物技术研究中心农业基因资源与生物技术北京市重点实验室、北京市农林科学院北京农业生物技术研究中心农业基因资源与生物技术北京市重点实验室、北京市农林科学院北京农业生物技术研究中心农业基因资源与生物技术北京市重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |