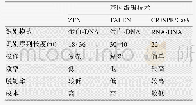
《表1.RNA干扰、单倍体细胞和CRISPR/Cas9筛选技术的优缺点》
利用各种形式的CRISPR系统,可以简单便捷地实现全基因组编辑,还可以根据具体的实验需求采用敲除、抑制或激活等不同的调节方式,弥补了RNAi、TALEN等技术的不足。但CRISPR技术仍存在许多改进的空间,主要是如何进一步提高靶向编辑效率并降低脱靶率。首先,对于任何DNA序列,“NGG”前的邻近基序PAM序列,都可以作为sgRNA的靶点,但整个基因组中存在着很多这样的靶向序列。目前已经有一些研究者针对CRISPR系统对于靶点序列的偏好性进行了研究。Doench等利用sgRNA文库对小鼠和人类的细胞表面标记进行筛选,发现新的PAM序列“CGGH”(H=A、C或T)比一般认定“NGG”的PAM序列效果更好[62];其次,也有必要对CRISPR系统中所需要的Cas酶进行改造,Ran等发现了一种源自金黄色葡萄球菌的新型saCas9并成功地应用于哺乳动物基因组的编辑[63],因其基因组较小,极大地提高了慢病毒效价,在基因敲除领域具有更广的应用前景;而Zetsche等发现了一种源自毛螺旋菌科的CRISPRⅡ型蛋白Cpf1,与Cas9相比,Cpf1仅需一段42–44个核苷酸组成的单链RNA即可识别和切除DNA,从而简化了实验设计步骤,更有利于多基因编辑[64]。随着对更多来自其他物种的Cas家族蛋白的逐渐开发,在未来很可能会找到性能更好、适用于不同实验目的的新型Cas酶。这样随着CRISPR系统相应组件的逐渐优化以及技术的不断成熟,该技术的应用前景将十分广阔!
| 图表编号 | XD0043801400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.05.04 |
| 作者 | 孙慧敏、李素、王文静、仇华吉 |
| 绘制单位 | 中国农业科学院哈尔滨兽医研究所、中国农业科学院哈尔滨兽医研究所、中国农业科学院哈尔滨兽医研究所、中国农业科学院哈尔滨兽医研究所 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式