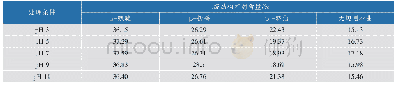
《表1 不同浓度Ba2+处理的酚氧化酶二级结构含量》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《Ba~(2+)对南美白对虾酚氧化酶活性和结构的影响》
采用Peak Fitv 4.12对分别经不同浓度Ba2+处理的PO酶红外光谱酰胺Ⅲ带进行基线调整、去卷曲、二阶求导、曲线拟合,经多次拟合使残差(r2)大于0.99,根据酰胺Ⅲ带各子峰归属二级结构类型,依据相应吸收峰面积百分比得出相应二级结构含量,结果见表1。从表1中可以看出,分别经不同浓度Ba2+处理的南美白对虾PO酶与未处理的PO酶相比,二级结构空间构象类型含量发生了变化,未处理的PO酶含有20.69%的α-螺旋,27.54%的β-折叠,22.52%的β-转角和29.25%的无规则卷曲。经1×10-5 mol/L Ba2+处理的PO酶,α-螺旋和β-转角含量比对照组增加,无规则卷曲和β-折叠含量减少。经1×10-4 mol/L Ba2+处理的PO酶,α-螺旋和无规则卷曲含量比对照组减少,β-转角和β-折叠含量比对照组增加,结合图1可以发现,经这2个浓度的Ba2+处理的PO酶活性是增加的。经1×10-2和1×10-1 mol/L Ba2+处理的PO酶,α-螺旋、β-转角和β-折叠含量比对照组高,无规则卷曲含量比对照组低,结合图1可以发现,经这2个浓度的Ba2+处理的PO酶活性是降低的。在蛋白质中,α-螺旋和β-折叠一般不是酶的活性中心,也不是配体以及底物的结合中心,主要是稳定蛋白质空间结构的[17],从表1中可以看出,经Ba2+处理的PO酶的α-螺旋和β-折叠均发生了变化,说明PO酶的空间构象发生了变化,趋向不稳定状态变化,结合图1结果,分别经10-5和10-4mol/L的Ba2+处理的PO酶活性是增加的,说明这种变化在最初的时候是有利于酶与底物的结合,对酶具有激活作用,其原因可能是适当浓度的金属离子的加入,使得酶与金属离子间发生水合作用,增加了酶与底物间的接触面积,增加了底物进入到酶活性中心的机会,所以酶活性增加。随着Ba2+浓度的增加,PO酶肽链上的侧链氨基酸展开,酶分子间容易发生聚集,活性中心被包埋,影响底物与酶之间的结合,最终导致酶活性降低。
| 图表编号 | XD00195392500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.20 |
| 作者 | 佟抒洋、张书琪、郭雨晴、张俊健、张弛、吕艳芳 |
| 绘制单位 | 渤海大学食品科学与工程学院、渤海大学食品科学与工程学院、渤海大学食品科学与工程学院、渤海大学食品科学与工程学院、渤海大学食品科学与工程学院、渤海大学食品科学与工程学院 |
| 更多格式 | 高清、无水印(增值服务) |