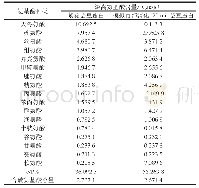
《表2 芸豆蛋白和改性芸豆蛋白DSC分析结果》
注:同列比较,相同字母差异不显著,不同字母差异显著。
根据差示热量图谱得表2,可以看出与芸豆蛋白相比较,超声辅助糖基化芸豆蛋白、未超声辅助糖基化芸豆蛋白的热变性温度分别下降了6.1,4.95℃,焓变分别下降了3.25,1.96 J/g。糖基化蛋白与芸豆蛋白之间差异显著(P<0.05),两种糖基化芸豆蛋白间差异不显著(P>0.05)。其原因可能在于糖基化改性过程中,热处理破坏了如氢键、疏水作用、静电作用和二硫键等[27],使蛋白结构稳定存在的力,使蛋白质部分结构发生折叠,分子内部作用力降低。由于变性温度反映蛋白质的热稳定性,而变性焓则反映蛋白质分子的疏水性和/或亲水性[28],所以在反应过程中,蛋白质结构受到了影响,内部的疏水基团发生包埋,引入了糖基的亲水基团,导致变性温度降低,这一结论也在对芸豆蛋白及改性芸豆蛋白的红外光谱分析中得到证实。由于接枝反应属于一级放热反应,故也加大了蛋白对热处理的敏感性。
| 图表编号 | XD0082854900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.07.31 |
| 作者 | 冯玉超、王长远、李玉琼、全越、张东杰 |
| 绘制单位 | 黑龙江八一农垦大学食品学院、黑龙江八一农垦大学食品学院、国家杂粮工程技术研究中心、黑龙江八一农垦大学食品学院、黑龙江八一农垦大学食品学院、黑龙江八一农垦大学食品学院、国家杂粮工程技术研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式