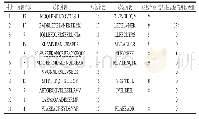
《表1 MALDI-TOF质谱检测到的肽段分析》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《Thermotoga sp.RQ7内切纤维素酶TsCel12A蛋白的酶学性质和晶体学研究》
TsCel12A融合蛋白在E.coli BL21 (DE3)菌株中表达,His-TsCel12A共有277个氨基酸残基,理论大小约为34kDa.在重复纯化的过程中,目的蛋白位置附近存在十分接近且难以分离的条带(图1 (a),见第492页).因其酶学性质的测定表明此酶在80℃以上的高温环境中不发生变性,故对破碎后的菌体取得的上清增加80℃处理30min后15 000r/min离心15min的操作以提高纯度.将热处理后二次离心的上清进行镍柱亲和层析,纯化得到了位置均一的洗脱样品(图1 (b),见第492页).将样品浓缩至5mL,经凝胶过滤层析柱洗脱得到了单一蛋白峰(图1 (c),见第492页),进行SDS-PAGE检验,目的蛋白纯度可达95%以上,位置较理论值偏小,原因可能为热处理过程使其构型更加紧密.对照凝胶过滤层析中标准品的出峰体积(图1 (d),见第492页),判断Ts Cel12A蛋白在溶液中以单体形式存在.进行MALDI-TOF质谱分析,检测到了第38~60位、第191~221位、第265~277位氨基酸肽段的信号(表1),且期望值0.000 17<0.01,进一步验证了所获蛋白为目的蛋白.Bradford法测定蛋白浓度约为15mg/mL.
| 图表编号 | XD0057726700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.08.01 |
| 作者 | 李媛、张丽、陈安琪、季朝能 |
| 绘制单位 | 复旦大学生命科学学院、复旦大学生命科学学院、复旦大学生命科学学院、复旦大学生命科学学院 |
| 更多格式 | 高清、无水印(增值服务) |