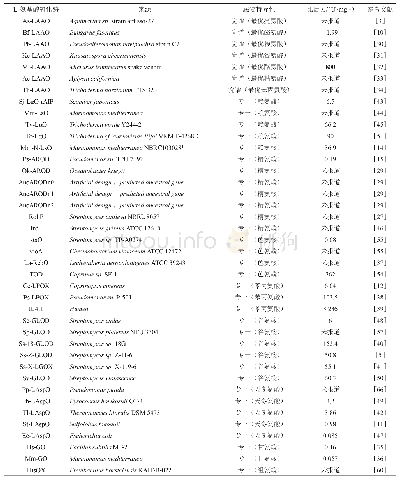
《表2 本文中列举的不同底物特异性的LAAO的来源、底物特异性、比活力等酶学性质》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《L-氨基酸氧化酶的结构、底物谱、家族进化及应用研究进展》
从底物专一性的严格程度上看,目前发现的底物专一性LAAO中,有些酶具有高度的专一性,只能特异性识别特定底物,对其他氨基酸,甚至是结构类似的氨基酸均无活性(表2).来自端链霉菌(Streptomyces endus)的谷氨酸氧化酶,对谷氨酸的比活力是6 U/mg,但对类似物谷氨酰胺、天冬氨酸,以及其他氨基酸均无活性[48];来自超嗜热古菌(Pyrococcus horikoshii OT-3)的天冬氨酸氧化酶,对天冬酰胺和谷氨酸,以及其他氨基酸也无明显活性[49];来自地中海海洋单胞菌(Marinomonas mediterranea NBRC 103028T)的赖氨酸氧化酶,对赖氨酸的比活力是36.9 U/mg,对精氨酸以及其他氨基酸均无活性[14].这些例子为研究高度底物特异性识别机制提供了良好的素材.相比于这些高度专一的酶,还有一些除了对偏好底物有较高的活性,对偏好底物的类似氨基酸也有一定活性(表2).例如:来自紫色链霉菌(Streptomyces violascence)的谷氨酸氧化酶,除了对谷氨酸的比活力为60.3 U/mg,对谷氨酰胺也有一定活性,比活力为19.3 U/mg[50];来自黄绿木霉菌(Trichoderma cf.aureoviride Rifai VKM F-4268D)的赖氨酸氧化酶,除了对L-赖氨酸的比活力为90 U/mg,对L-精氨酸和非蛋白质氨基酸L-鸟氨酸也具有较弱活性,比活力分别为5.2 U/mg、7.5 U/mg[51];来自假单胞菌(Pseudomonas sp.TPU 7192)的精氨酸氧化酶能够识别L-精氨酸,同时也能识别L-赖氨酸,比活力为0.019 U/mg[15].还有些酶能够特异性识别带有芳香环侧链的底物,如来自紫色杆菌(Chromobacterium violaceum ATCC 12472)[52]和海洋链霉菌(Streptomyces sp.TP-A0274)[53]的色氨酸氧化酶能够识别L-色氨酸,也能够轻微识别L-苯丙氨酸,可能是由于两种氨基酸具有疏水的芳香环;来自鬼伞属真菌(Coprinus sp.SF-1)的色氨酸氧化酶,能够识别L-色氨酸,同时能够轻微识别L-苯丙氨酸和L-酪氨酸[54].底物特异性的LAAO为我们研究底物特异性分子机制,以及探讨不同底物特异性LAAO的进化关系,也提供了重要的素材.
| 图表编号 | XD00206346900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.20 |
| 作者 | 陆泽林、越皓、张艺凡、于珊珊、杨广宇、马富强 |
| 绘制单位 | 长春中医药大学吉林省人参科学研究院、中国科学院苏州生物医学工程技术研究所、长春中医药大学吉林省人参科学研究院、中国科学院苏州生物医学工程技术研究所、长春中医药大学吉林省人参科学研究院、上海交通大学生命科学技术学院微生物代谢国家重点实验室、中国科学院苏州生物医学工程技术研究所 |
| 更多格式 | 高清、无水印(增值服务) |





