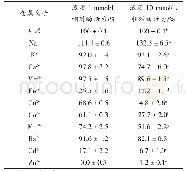
《表2 金属离子对宇佐美曲霉酸性蛋白酶活性影响*》
*蛋白酶麸曲浸出液添加终浓度为1×10-3mol/L,金属离子加入p H2.5酪蛋白40℃反应10 min,加三氯醋酸终止反应,过滤后滤液分别用紫外分光光度计测定280 nm之吸光度和添加Folin试剂发色后测定660 nm之吸光度,空白试验同上,唯三氯醋酸在加酪蛋白前添加。
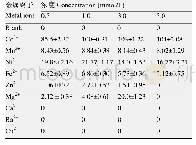
蛋白酶是一类复杂的酶,专一性极强,对其切开的肽键氨基酸组成有着严格的选择性,水解肽键的能力还受到肽键长度、切开点前后肽键氨基酸组成的影响,不同来源蛋白酶水解同一蛋白质的能力不同,同一蛋白酶水解不同蛋白质的能力也不同,故采用不同的蛋白酶测定方法,能反映蛋白酶对不同蛋白质底物的水解行为。上世纪50年代我国还没有酶制剂工业,也没有测定蛋白酶的标准方法,其时国外已发展了不少测定蛋白酶活性的方法,例如明胶液化法、明胶粘度下降法、明胶甲醛滴定法、酪蛋白血红蛋白沉淀法、275 nm紫外分光光度法、Folin试剂显色法,以及Gross-Fold法、DHT酪蛋白测定法等等。由于Folin试剂显色法灵敏度高,即使微弱的蛋白酶活性也可以显示出来,因此我们在国内首先选用了Folin试剂比色法来测定蛋白酶活性,那时光电比色计已算是很高级的仪器了,而Folin试剂得自己来合成,此法在国内推广后,经中国发酵协会验证后,申报国家标准局列为国家标准法。其实此法还存在一些问题尚待解决。我们在酸性蛋白酶研究时,用Folin法测定金属离子对酶活性的影响,发现向酶液添加终浓度2×10-3mol/L的铜、锰、铝等金属离子时,可明显提高酸性蛋白酶的活性,尤其这三者同时添加时,酶活性可增强三倍(表1),因而得出Cu2+、Mn2+、Al3+可激活酸性蛋白酶活性的结论,并发表在《微生物学报》[1976,16(3):220-223]和作者参与编写的《酶制剂工业》、《酶制剂生产技术》等书中,40多年来被广泛引用,但在2005年笔者等利用宇佐美曲霉酸性蛋白酶试制高效酒精发酵剂时,试图向酶粉添加铜离子等来增强蛋白酶活性,同一样品同时用紫外分光光度法测定法与Folin法测定酶活性,却发现用紫外分光光度法测定280 nm吸光值的方法,Cu2+、Mn2+等对酶活性非但无激活作用反而有轻度的抑制。虽然Folin法测定对这些金属离子对酶活性仍呈明显的促进作用(表2)。令人百思不解,查遍有关文献终于在日本酶学泰斗赤崛四郎1950年所著巨著《酵素研究法》第二卷蛋白酶一章中得到启发,他说“Folin法与紫外分光法相比,灵敏度高,尤其加有铜的Folin试剂灵敏度更高,适合于微量蛋白酶的检测,与之相反,紫外分光275 nm吸收法,不受加铜的影响”,可见铜离子的存在可引起酪氨酸与Folin试剂的蓝色反应增强而造成铜离子可增强蛋白酶活性之假像,以致造成误导,为此将此发现发表在《江苏调味剂食品杂志》,但未受到有关人员的注意,陆续有人在其文章中仍谈到铜等金属离子对酸性蛋白酶呈激活作用。令人费解的是我们在1967年进行栖土曲霉蛋白酶研究时,同样是用Folin法来测定金属元素对酶活性的影响的,却并未发现铜离子对中性蛋白酶的激活作用(表3),唯一的区别是酸性蛋白酶是在酸性环境下作保温处理,而中性蛋白酶是在中性环境下处理的,除此无法解释,这恐怕还有待于今后学者去探明了。
| 图表编号 | XD00192441800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.22 |
| 作者 | 胡学智 |
| 绘制单位 | 上海市工业微生物研究所 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式