《表2 金属离子作用微生物酸性蛋白酶研究》
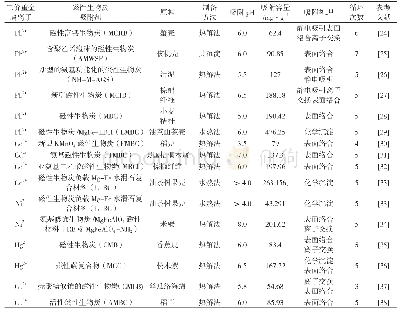
从表2可以看出Cu2+、Mn2+和Fe2+对酸性蛋白酶活性影响最为显著,在大部分研究中Mn2+对于酸性蛋白酶主要表现为激活作用,Lee等[14]的研究中添加1mmol/L的Mn2+使米曲霉LK-101的酸性蛋白酶相对酶活高达197%,添加1 mmol/L的Cu2+后酸性蛋白酶相对酶活达到184%。Yin等[11]的研究中添加10 mmol/L的Fe2+后,酸性蛋白酶相对酶活高达225%。从作用机理来看,Mn2+提高酸性蛋白酶活性的机理主要是Mn2+参与了酸性蛋白酶分子结构的稳定,防止其在催化反应过程中构象的变化,从而提高了反应速率,所以Mn2+常常作为酸性蛋白酶的稳定剂[15]。Cu2+激活酸性蛋白酶活性的机理研究主要在于Cu2+可以和酸性蛋白酶活性中心的天冬氨酸残基发生复杂的配体磷酸化反应,从而改变酸性蛋白酶的构象,天冬氨酸蛋白酶具有极其复杂的催化机制,这种通过变构而提高酶活的发现在Ida等[16]和Karsten[17]的研究中得到了验证。在很多研究报道中证明一定浓度的Fe2+对于酸性蛋白酶具有刺激作用,而作用机理尚不明确。王习文等[18]在金属离子对漆酶活性影响的相关研究中提及添加一定浓度的Fe2+能够提高漆酶活性,进一步研究发现Fe2+主要是通过与底物催化氧化产物ABTS·的反应来影响漆酶的活性,这一研究结果给Fe2+激活蛋白酶活性提供了一定的启示。然而,Fe2+对于不同菌株所产酸性蛋白酶作用效果不一致,比如在表2中方春玉[12]和张秀春[13]的研究结果表明Fe2+对酸性蛋白酶起抑制作用。
| 图表编号 | XD0047541900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.04.30 |
| 作者 | 余茜、张国丽、敖晓琳 |
| 绘制单位 | 四川农业大学食品学院、四川农业大学食品学院、四川农业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式