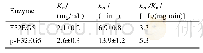《表2 突变前后酶反应动力学参数》
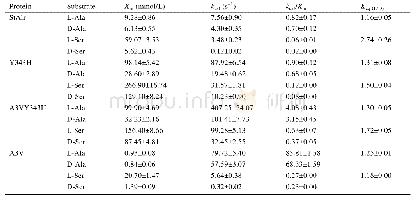
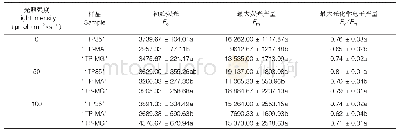
过氧化氢酶突变前后的酶学特性如表2所示。将K117分别突变为疏水性的残基(Val、Ile和Met)比酶活分别提高了31.7%、21.8%和8.48%,60℃的半衰期分别提高了38、23 min和9 min。K117V和K117I的kcat分别为319 427 s-1和317 185 s-1,比野生型展现出更高的催化效率。根据结构分析可知,117位的赖氨酸突变为疏水的缬氨酸后,会与92位的苯丙氨酸形成2个氢键的连接,并且与疏水性的93位缬氨酸和119位酪氨酸共同形成一个疏水性的孔道(图2(b))。疏水性的孔道与位于血红素附近主孔道的催化残基Asp110和Asn130相连接。之前的研究报道表明,活性位点附近的疏水性对酶的稳定起关键作用[33],疏水区域由于能增强稳定性,这可能是因为它增强了α-螺旋和β-折叠结构域之间的联系,而这一点与作为底物结合位点的配体有关[31]。因此117位亲水性的赖氨酸突变为疏水性的缬氨酸并在活性中心形成疏水区域是提高酶热稳定性的原因。将Lys117突变为其他疏水氨基酸(异亮氨酸和蛋氨酸)加强了与周围Phe114、Ala115、Val116、Phe118和Tyr119的相互作用,使疏水区域更加稳定,从而提高了酶的催化效率和热稳定性。另外,将Met177突变成脯氨酸,脯氨酸起着维持蛋白质形状和折叠的重要作用,从而提高蛋白质构象稳定性和催化效率[32].如图2(c)和2(d)所示,Met177和突变株P177M通过同样的氢键与Trp180、Leu181和Ser174形成极性连接,但是热稳定性和催化活性却有所差异,这可能是由于脯氨酸残基能提高构象的稳定性所导致的。
| 图表编号 | XD00174147400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.03.01 |
| 作者 | MUGISHA Samson、杨套伟、徐美娟、张显、ULIHO Alphonse、钱海峰、王立、饶志明 |
| 绘制单位 | 江南大学生物工程学院、江南大学工业生物技术教育部重点实验室、江南大学生物工程学院、江南大学工业生物技术教育部重点实验室、江南大学生物工程学院、江南大学工业生物技术教育部重点实验室、江南大学生物工程学院、江南大学工业生物技术教育部重点实验室、江南大学生物工程学院、江南大学工业生物技术教育部重点实验室、江南大学食品学院、江南大学食品学院、江南大学生物工程学院、江南大学工业生物技术教育部重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式