《表2 欧盟生物类似药药物警戒模块内容》
注:对于额外监测的生物类似药,欧盟要求在其包装小册子上标注倒三角符号(黑色),以表明此生物类似药纳入额外监测范畴,应当引起特殊注意和警戒。同时,药剂师应明确黑色倒三角形“▼”的含义,知晓这是生物药风险管理计划中的一部分,并且明晰保证可追溯性是强制性要求。额外
同时,欧洲药品管理局(EMA)于2016年发布了一个针对生物药的新GVP模块(EMA/168402/2014)[15],对生物类似药进行了明确界定,表示其应当在质量特征、生物活性、安全性和功效方面与参比原研药具有相似性。各部分包括第一部分P.Ⅱ.A、第二部分P.Ⅱ.B和第三部分P.Ⅱ.C除对生物药的一般规定外,还有对生物类似药的特殊规定,生物类似药企业均应当遵循,如类似药的追溯与评估要贯穿全生命周期、分阶段持续进行;要充分调查怀疑具有免疫原性的任何新临床风险并确定风险最小化或消除可能性;上报参考品与类似药间的任何重要差异并由专家做出评估等(表2)。
| 图表编号 | XD0011188700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.11.22 |
| 作者 | 蒋蓉、董心月、邵蓉 |
| 绘制单位 | 中国药科大学国家药物政策与医药产业经济研究中心、中国药科大学国家药物政策与医药产业经济研究中心、中国药科大学国家药物政策与医药产业经济研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
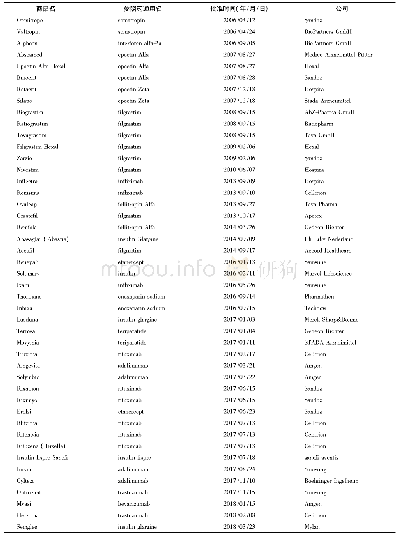
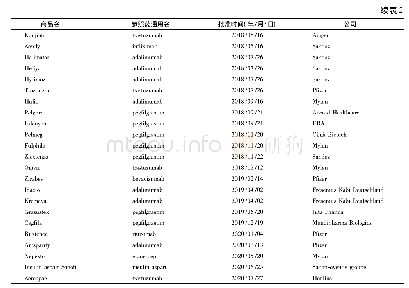


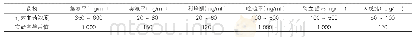
![表2 中国已获批上市的8款生物类似药[4]](http://bookimg.mtoou.info/tubiao/gif/SYZZ202101004_02200.gif)