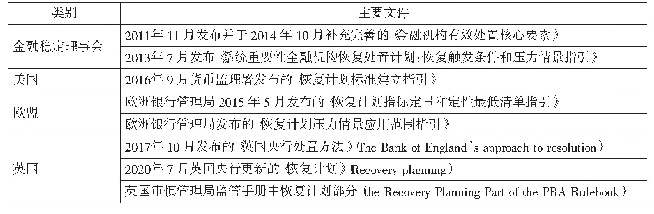
《表2 欧盟药物警戒制度立法的主要文件》
资料来源:科睿唯安Cortellis RI全球药政法规情报数据库
1965年1月,欧盟理事会颁布第65/65号(EEC)指令,标志欧盟药事立法的开始。2001年,欧盟颁布第2001/83号(EC)指令,统一了人用药品相关的规定,专门设置第9章规定药物警戒的总体要求。2010年通过的第2010/84号(EU)指令和第1235/2010号(EU)法规,于2012年7月正式生效,修订后的药物警戒法规对欧盟药物警戒制度进行了实质性的更新,完善了关于药品上市后监测的法律体系,明确了药品主管机构和持有人的分工和责任[3]。2012年,欧盟颁布了第2012/26号(EU)指令和第1027/2012号(EU)法规,提高了药物警戒制度的执行要求,特别是对药品安全性问题的及时通知和评估。同年,为支持新法的实施,欧盟制定了《药物警戒实践指南》(Good Pharmacovigilance Practices,GVP),为药物警戒工作的开展提供了一整套的指南。欧盟药物警戒制度立法的主要文件见表2。GVP共包括16个模块(见表3),涵盖药物警戒的主要方面,目前已制定完成,其中模块编号Ⅺ、Ⅻ、和因有其他指导文件替代而保持无效状态[4]。
| 图表编号 | XD00128879400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.01.01 |
| 作者 | 胡歆雅、梁玉、曾亚莉、王刚、梁毅 |
| 绘制单位 | 中国药科大学国际医药商学院、中国药科大学国际医药商学院、科睿唯安、科睿唯安、中国药科大学国际医药商学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式