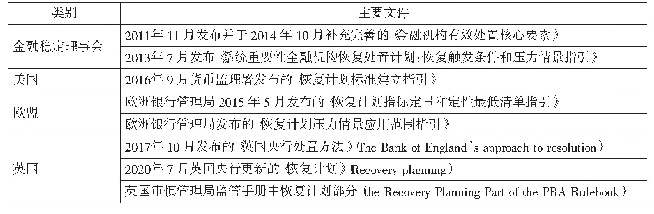
《表1 中国药物警戒制度相关的主要文件》
资料来源:科睿唯安Cortellis RI全球药政法规情报数据库
1998年,中国开始建立药品不良反应监测与报告制度,鼓励企业自主上报药品不良反应。2004年3月原国家食品药品监督管理局和卫生部共同颁布《药品不良反应报告和监测管理办法》(局令第7号)。2011年,《药品不良反应报告和监测管理办法》(简称“81号令”,下同)发布,正式规定了药品生产企业、药品经营企业、医疗机构应报告药品不良反应以及药品监管部门在药品不良反应监管中所承担的责任和义务,详细说明了药品不良反应报告、定期安全性更新报告(PSUR)和重点监测的要求[2]。2017年,中国正式加入人用药品注册技术要求国际协调会议(ICH),开始逐步适用ICH指导原则,药物不良反应的报告和电子传输开始与国际接轨。2018年,《关于药品上市许可持有人直接报告不良反应事宜的公告》(简称“66号公告”,下同)正式发布,明确药品上市许可持有人(简称“持有人”,下同)建立药品不良反应监测体系、及时报告药品不良反应、加强不良反应监测数据的分析评价及采取有效的风险控制措施的主体责任,进一步完善了我国药品不良反应监测制度。2019年,新《药品管理法》正式将药物警戒制度立法,规定“国家建立药物警戒制度,对药品不良反应及其他与用药有关的有害反应进行监测、识别、评估和控制”,我国对药物警戒工作的重视程度进一步提升,药物警戒制度的建设与发展开始进入新篇章。中国药物警戒制度相关的主要文件见表1。
| 图表编号 | XD00128879600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.01.01 |
| 作者 | 胡歆雅、梁玉、曾亚莉、王刚、梁毅 |
| 绘制单位 | 中国药科大学国际医药商学院、中国药科大学国际医药商学院、科睿唯安、科睿唯安、中国药科大学国际医药商学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式