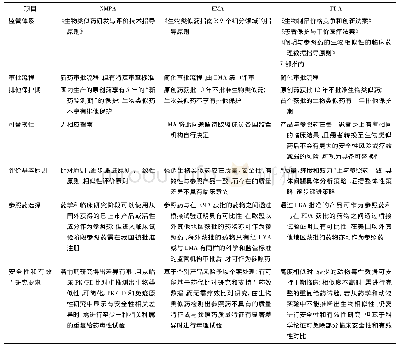
《表1 欧盟生物类似药注册审评指南体系》
欧盟从2003年开始对生物类似药注册审评进行立法,至今分别针对药物质量、临床和非临床研究、不同类别产品开发原则、生产技术、可比性研究等细分领域出台了系列指令、指南和报告(表1)。依据2001/83/EC指令Article 10(4),生物类似药必须执行比较性研究(comparability studies)来证实与参比原研药的相似性。对于临床前与临床资料可依个案适度减免。但若所提交的信息不能够完全展示两种生物药产品在性质上的相似性,则应提供额外补充数据,尤其是在毒理学及临床使用方面的数据。命名方面,欧盟对生物类似药授予了与原研药完全相同的通用名。
| 图表编号 | XD0011188500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.11.22 |
| 作者 | 蒋蓉、董心月、邵蓉 |
| 绘制单位 | 中国药科大学国家药物政策与医药产业经济研究中心、中国药科大学国家药物政策与医药产业经济研究中心、中国药科大学国家药物政策与医药产业经济研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式