《表9 生物类似药在欧盟获批案例利妥昔单抗(rituximab)》
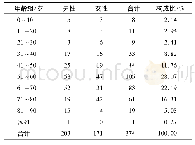
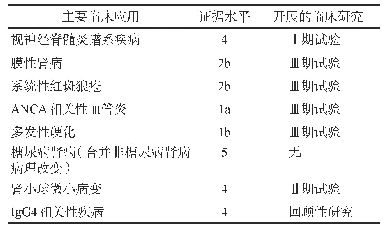
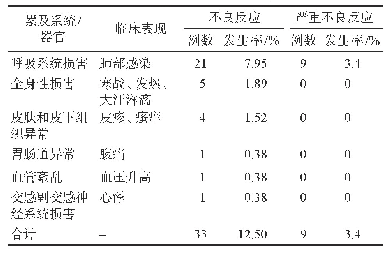
欧盟生物类似药指南[3]指出如果在一个适应证中证明了生物相似性,在适当的科学论证下允许生物类似药外推到参比产品(参照药)的其他适应证。欧盟生物类似药指南[3]进一步指出参比产品(参照药)可能有多个治疗适应证。当在一个适应证中证明了生物相似性时,如有科学证据,可将生物类似药的临床数据外推到参比产品的其他适应证中。如果在某一适应证中确认的安全性和有效性是否与另一个适应证相关存在不确定性,则需要额外补充数据。2017年在EMA批准上市的2个利妥昔单抗(rituximab)生物类似药(Rixathon和Truxima)是适应证外推的典型案例(详见表9)。
| 图表编号 | XD00218141300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.15 |
| 作者 | 王兰 |
| 绘制单位 | 中国食品药品检定研究院卫生部生物技术产品检定方法及标准化重点实验室国家药品监督管理局生物制品质量研究与评价重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式