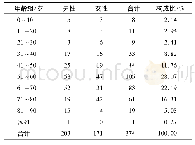
《表1 生物类似药利妥昔单抗注射液的QTPP列表》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《基于质量源于设计策略的单抗生物类似药开发和质量研究》
注:CD20表示一种B细胞分化抗原
在生物类似药利妥昔单抗注射液(商品名:汉利康)的质量研究中,采用QbD分析相似性评价策略,从QTPP的建立出发、经历CQA评估、分析相似性实验、相似性接受标准制定和判别,对汉利康与原研参照药利妥昔单抗注射液(商品名:美罗华)进行了比较。首先,根据美罗华的公开信息和3批中国市售的美罗华产品的特性表征建立了汉利康的QTPP列表,以指导后续工艺的开发和优化。见表1。随后,根据利妥昔单抗的结构、作用机制、有效性和安全性确定汉利康的质量属性,并在此基础上开发科学可靠、灵敏度高、适用性强的分析方法以最大限度地检测汉利康和参照药之间的质量属性差异[20]。在质量属性研究初步完成后,构建潜在关键质量属性(potential critical quality attribute,pCQA)列表,以确保汉利康的质量能满足QTPP的定义,并根据ICH指南中的风险评估原则,基于全面的科学文献调查和结构-功能相关性实验,使用RRF模型[12]确立CQA列表。在分析相似性试验中,研究人员遵循国家药品监督管理局药品评审中心发布的相似性评价指导原则[3],并参考欧美药监机构和ICH的相关要求[16-19],采用一系列的正交实验对12批次汉利康和15批次中国市售与12批次欧盟市售的美罗华展开头对头的质量属性比对分析[20]。最后,根据质量属性风险评估结果,将每个质量属性分配到代表高、中、低风险的3个层级(Tier1~3)中,并根据不同层级预定义的相似度接受标准,使用定量或定性分析来评估这些质量属性在汉利康和美罗华之间的分析相似性。
| 图表编号 | XD00165603600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.05.01 |
| 作者 | 谢力琦、曹婷、沈朋程、谢红伟 |
| 绘制单位 | 上海抗肿瘤生物药物工程技术研究中心、上海抗肿瘤生物药物工程技术研究中心、上海抗肿瘤生物药物工程技术研究中心、上海抗肿瘤生物药物工程技术研究中心 |
| 更多格式 | 高清、无水印(增值服务) |