《表1 不同金属离子对甲醇芽孢杆菌凝乳酶凝乳活性的影响》
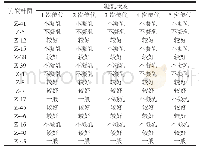
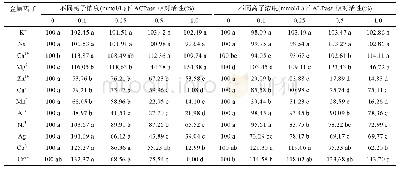
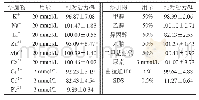
IPTG诱导表达的融合蛋白pET28a(+)-I3EB99在低温条件下通过镍柱进行分离纯化,收集洗脱液浓缩透析后对各洗脱峰进行SDS-PAGE,结果发现咪唑浓度为150 mmol/L时蛋白洗脱效果最好(图4A),但经过反复实验均发现分子质量为80.34 kDa的目标凝乳酶在纯化后的SDS-PAGE结果中存在分子质量约为45 kDa和35 kDa的两个小分子蛋白,且二者分子质量总和为目标凝乳酶分子质量。因此可推测目标凝乳酶在纯化洗脱过程中可能发生了自身剪切,自主降解为两个小分子蛋白,最终得到的是3个蛋白混合物,加入蛋白酶抑制剂cocktail后自身降解现象可被部分抑制,有文献报道指出,乙二胺四乙酸的存在可完全抑制蛋白酶的自身降解[24],但同时也会使酶活完全损失。一般而言内源蛋白的产生和降解都维持在一个平衡状态,因此在稳定的环境因素下细胞内的蛋白含量也是稳定的[25],但是在体外研究中,蛋白合成过程终止,从而降解大大增强。得到的该蛋白组分只有溶解在含50 mmol/L的Mg2+溶液中时会产生凝乳效果(表1),且具有凝乳活性的蛋白酶组分质量浓度测定结果为0.70 mg/m L,凝乳活力为(15 870±1.17)SU/g,蛋白水解活力为(263.81±0.94)U/g,即凝乳活力/蛋白水解活力(C/P)值为60.16,与文献中已报道的C/P值为80.45[26]相接近。该酶溶解在其他金属离子溶液中的蛋白酶不具有凝乳能力,说明此凝乳酶的凝乳活力可通过Mg2+进行活化。待蛋白酶完全降解后得到2个小分子蛋白后(图4B),丧失了凝乳能力,说明该蛋白酶在分离纯化的同时会发生自我断裂使保持其具有凝乳活性的蛋白结构遭到破坏。将分离纯化后具有凝乳活性的凝乳酶放在-80℃保存备用。
| 图表编号 | XD00111476500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.11.25 |
| 作者 | 李柳、郑喆、吴凤玉、郝一江、赵笑、曹永强、余志坚、陈超、杨贞耐 |
| 绘制单位 | 北京食品营养与人类健康高精尖创新中心食品添加剂与配料北京高校工程研究中心北京工商大学、北京食品营养与人类健康高精尖创新中心食品添加剂与配料北京高校工程研究中心北京工商大学、北京食品营养与人类健康高精尖创新中心食品添加剂与配料北京高校工程研究中心北京工商大学、北京食品营养与人类健康高精尖创新中心食品添加剂与配料北京高校工程研究中心北京工商大学、北京食品营养与人类健康高精尖创新中心食品添加剂与配料北京高校工程研究中心北京工商大学、东君乳业(禹城)有限公司、东君乳业(禹城)有限公司、东君乳业(禹城)有限公司、北 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式