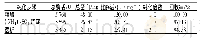《表2 重组普鲁兰酶的纯化》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
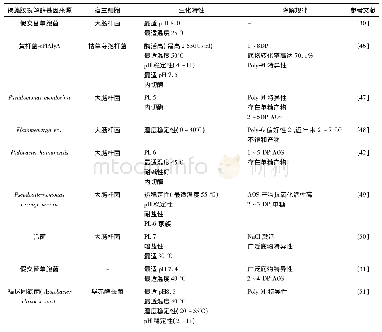
《Paenibacillus puldeungensis LK18普鲁兰酶基因的克隆表达及酶学性质研究》
将粗酶液进行Ni柱亲和层析,收集各个梯度下观察到出峰时的洗脱液,并进行SDS-PAGE检测及酶活力测定。如图5所示,与重组菌的菌体破碎上清液相比,经Ni柱亲和层析纯化后的蛋白条带较为单一。重组普鲁兰酶的纯化结果见表2,其比酶活为508.8U/mg,纯化了2.36倍,回收率达41.89%。与已报道的相比,如Wu等人将来源于Thermus thermophilus的普鲁兰酶基因在大肠杆菌中进行异源表达,其比酶活为280 U/mg[20];Bertoldo等人将来源于Anaerobranca gottschalkii的普鲁兰酶在大肠杆菌中表达,比酶活达56 U/mg[21];Liu等人将Paenibacillus barengoltzii来源的普鲁兰酶基因在大肠中进行表达,重组酶的比酶活达68.3 U/mg[22],本研究所表达的重组普鲁兰酶的比酶活较高,具有一定的工业应用价值。
| 图表编号 | XD0088819500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.07.20 |
| 作者 | 苏红玉、崔堂兵 |
| 绘制单位 | 华南理工大学生物科学与工程学院、华南理工大学生物科学与工程学院 |
| 更多格式 | 高清、无水印(增值服务) |