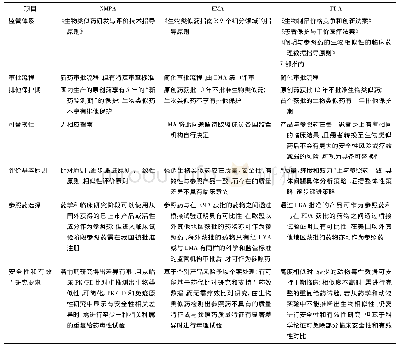
《表1 中国台湾地区细胞治疗产品主要监管法律法规与指南规范》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《中国台湾地区细胞治疗产品临床试验监管及对大陆地区的启示》
人类细胞治疗产品系指取自人类自体细胞或同种异体细胞,经加工或体外培养程序,再将整个细胞引进患者体内,用以预防、治疗或诊断人类疾病为目的的产品(包括细胞治疗技术)。在中国台湾地区现行药事法及医疗法规中,细胞治疗属于临床试验新药管理范畴[3],见表1。中国台湾地区在2014年9月17日正式颁布了《人类细胞治疗产品临床申请作业与审查基准》(以下简称《基准》),并于2019年1月发布其修订版,为中国台湾地区细胞治疗产品管理奠定了基础。《基准》与美日管理审查标准同步,不仅作为临床试验的参考依据,还促进了细胞研发公司与医疗机构的合作,缩短了细胞治疗产品从研发到上市的时间。本研究分别从申请资格、申请程序、细胞产品风险评估3方面介绍中国台湾地区细胞治疗产品临床试验申请的基本情况。
| 图表编号 | XD00211290000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.15 |
| 作者 | 敖唯一、梁毅 |
| 绘制单位 | 中国药科大学国际医药商学院、中国药科大学国际医药商学院 |
| 更多格式 | 高清、无水印(增值服务) |