《行表2 我国出台的关于细胞治疗领域的政策法规和指南》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《美国人体细胞、组织以及基于细胞和组织的产品的捐赠者资格监管研究》
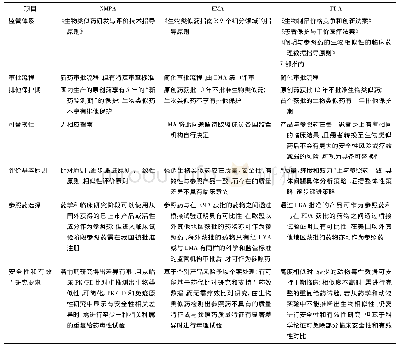
一般来说,细胞治疗分为干细胞治疗和免疫细胞治疗[9]。我国2015年发布了《干细胞制剂质量控制和临床前研究指导原则(试行)》的文件,这是国内首个对干细胞临床前研究进行规范性管理的法规。该法规中对干细胞供体的要求如下:干细胞制剂都需要有供体信息,并且需要提供干细胞的获取方式、途径以及相关临床资料,包括供者的一般信息、既往病史、家族史等。对用于异体干细胞临床研究的供者,必须经过检验筛选证明无人源特定病毒(包括HIV、HBV、HCV、HTLV、EBV、CMV等)的感染,无梅毒螺旋体感染。必要时需要收集供者的ABO血型、HLA-Ⅰ类和Ⅱ类分型资料,以备追溯性查询。如使用体外受精术产生的多余胚胎作为建立人类胚胎干细胞系的主要来源,须能追溯配子的供体,并接受筛选和检测。不得使用既往史中患有严重的传染性疾病和家族史中有明确遗传性疾病的供者作为异体干细胞来源。自体来源的干细胞供者,根据干细胞制剂的特性、来源的组织或器官,以及临床适应证,可对供体的质量要求和筛查标准及项目进调整。2017年中国细胞生物学学会发布了《干细胞通用要求》,其中在原材料要求部分,有如下要求:干细胞来源要符合伦理和当地法律要求;干细胞供者要签署知情同意书;干细胞研究和生产组织要建立并实施供者评估标准,保证每一株干细胞都有相应的获取方式、途径和临床资料。这两份法规是涉及我国细胞治疗类产品供体来源的,也是保障我国细胞治疗产品供体安全性的法律依据。
| 图表编号 | XD00218342000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.05 |
| 作者 | 宋佳阳、武志昂、胡明 |
| 绘制单位 | 四川大学华西药学院、四川大学华西药学院、四川大学华西药学院 |
| 更多格式 | 高清、无水印(增值服务) |