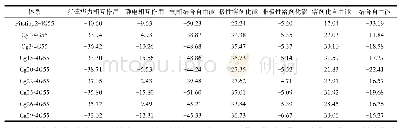
《表2 A构象中有显著的结合自由能 (绝对值大于4.182kJ·mol-1) 的残基及其分解的结合自由能数值》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《Cel48F产物排出过程中酶-底物相互作用及关键残基的分子动力学模拟》
从表1中可以看出,在-3~-1子位置一端,由于其位置在不同构象中未发生变化,因此酶中残基与其形成的氢键的变化也相对较小,在A、B构象中,存在几率最高的氢键几乎完全一致,包括Ser 54~-1糖单元,Glu 55~-1、+1糖单元的多氢键,Trp 298~-2糖单元,Trp 154~-3糖单元,Phe 180~-3糖单元.结合自由能的结果可以进一步验证这些氢键,表2~表4中列出了3种构象中拥有较明显静电、范德华或总结合自由能贡献的残基(绝对值大于4.182kJ·mol-1).从A构象的结合自由能计算(表2)中可以看出,Trp 154和Phe 180中,并没有较明显的静电贡献,反而是范德华作用非常明显,这说明以上2个残基与底物间的靠近主要是由于形成疏水相互作用而不是氢键,高的氢键存在率只是因为在统计时相关原子恰好处于氢键范围内.不管是氢键还是疏水相互作用,在A、B构象中是相当稳定的,它们可以将底物束缚在特定的底物结合位置上.在这2种构象中,只有Asp 230~-1糖单元间的氢键存在率发生了较大变化(从99.84%降到9.68%),这可能与Asp 230的功能与其他残基不同有关,在之前的研究中,Asp 230被认为是关键结合亲核水分子的碱残基,因此,在水解前(A构象),它应与底物有较强的相互作用,以保证水分子能够进攻正确的位置,而在水解后(B构象),它应该远离底物,使逆反应不易发生.与A、B构象中糖单元位置基本没有变化不同,在C构象中,由于产物移动到了+2~+3子位置上,使其离残余的-3~-1糖链较远,两者间相互作用减小,因此导致了-3~-1糖链也有一个很小的位置变化并使其与底物间氢键有一定变化.但是,存在率最高的几个氢键,如Phe 180~-3糖单元、Trp 298~-2糖单元间的氢键仍能保持.氢键的变化主要体现在Glu 54~-1糖单元、Glu 55~-1糖单元、Trp 154~-3糖单元间氢键存在率的降低及新的Asn 227~-2糖单元和Tyr 323~-1糖单元间的氢键存在率的升高.
| 图表编号 | XD0042005900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.02.01 |
| 作者 | 刘天志、董莹、鄂镜雯、韩菲、李卓、张浩 |
| 绘制单位 | 盛实百草药业有限公司、吉林大学理论化学研究所、吉林大学白求恩制药厂、吉林大学理论化学研究所、吉林大学理论化学研究所、吉林大学理论化学研究所、吉林大学理论化学研究所 |
| 更多格式 | 高清、无水印(增值服务) |