《表1 FDA拓展性使用药物的监管机制》
美国的“拓展性使用药物计划(Expanded Access Programme)”已运行30多年,美国食品和药物管理局(FDA)主要通过建立法规、发布指南、完善制度来建立监管体系[1,2]。FDA拓展性使用临床试验药物的法规依据是美国联邦法规21 CFR 312 Subpart I(Investigational New Drug Application-Expanded Access to Investigational Drugs for Treatment Use),申请的适用范围包括[3]:(1)该患者患有严重或危及生命的疾病或病症,无法通过有效手段来治疗疾病或改善症状。(2)患者无法参加相关的临床试验。(3)对于患者而言,拓展性使用研究药物对患者潜在的获益大于风险。(4)药物的拓展性使用不会影响其注册临床研究。法规中明确的拓展性使用方式有3种,分别为单个患者使用、中等数量患者使用、大人群治疗,这3种方式的相同点在于:医师或制药企业可提交拓展性使用的申请,且均需得到FDA的批准方可开展实施,拓展性使用的费用可由患者自付或制药企业免费提供,其中收费需要向FDA提交申请并获得书面批准。这3种拓展性使用方式的不同点及其申请要求、保障措施等参见表1[1,3]。此外,FDA官网上罗列了3部相关技术指南,分别为《关于临床试验药物拓展性使用相关问题的解答指南(Expanded Access to Investigational Drugs for Treatment Use-Questions and Answers)》、《单个患者拓展使用申请(Individual Patient Expanded Access Applications:Form FDA 3926)》和《关于临床试验药物收费相关问题的解答指南(Charging for Investigational Drugs Under an IND-Questions and Answers)》,并为医师、拓展性使用申请人、患者三方提供了如何申请等详细信息,使得法规落实到实践层面更加清晰,为患者提供临床试验药物的同时保障患者的安全,并避免干扰药物的研发进展。
| 图表编号 | XD00227507700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.25 |
| 作者 | 赵真、董正龙、翁志洁 |
| 绘制单位 | 上海药品审评核查中心、上海药品审评核查中心、上海药品审评核查中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式


![表1 欧盟两种临床试验药物拓展使用计划实施方式比较[6]](http://bookimg.mtoou.info/tubiao/gif/XYYL202005006_01100.gif)
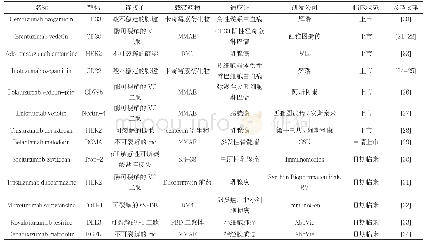
![表2 部分欧盟成员国临床试验药物拓展使用实施方式[6,8]](http://bookimg.mtoou.info/tubiao/gif/XYYL202005006_02300.gif)