《表1 FDA药品评价与研究中心、生物制品评价与研究中心、医疗器械与放射健康中心的拓展性使用申请统计》
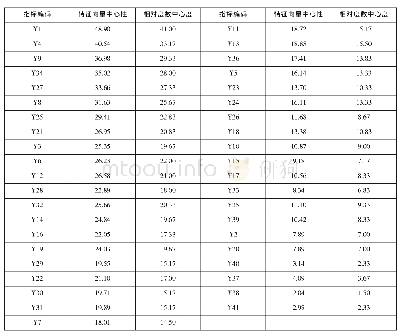
2005年1月至2014年12月,FDA药品评价与研究中心(the center for drug evaluation and research,CDER)收到10 939份拓展性研究药物使用申请,平均每年1 000多份,大多数是对于单个患者,在紧急和非紧急使用之间大致平均分配[6]。单个患者IND非紧急情况5 284件,单个患者IND紧急情况5 511件,中等数量患者IND 116件,大量人群IND28件。在所有的申请中99.7%允许进行,搁置率(申请批准后未开展)为7.9%。2014~2016年,FDA药品与医疗器械拓展新研究药物的申请数量持续增长(表1)。
| 图表编号 | XD00213825300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.06 |
| 作者 | 马静、高京宏、刘春光 |
| 绘制单位 | 武警北京总队医院药剂科、武警北京总队医院药剂科、武警北京总队医院药剂科 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式

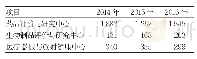
![表3 2016-2019年美国拓展性同情用药申请与批准量[12]](http://bookimg.mtoou.info/tubiao/gif/ZGYS202012010_04600.gif)