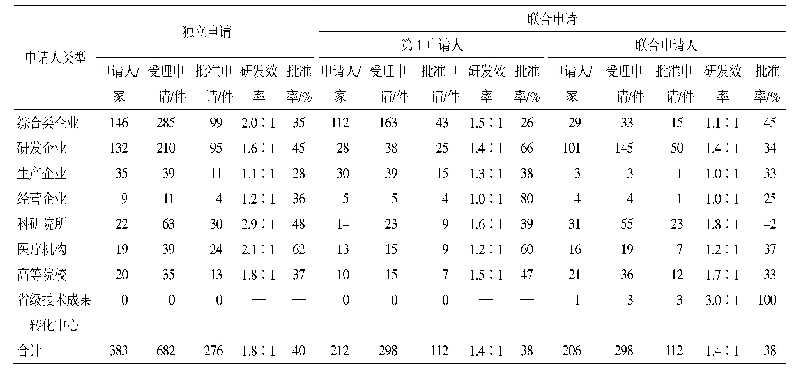
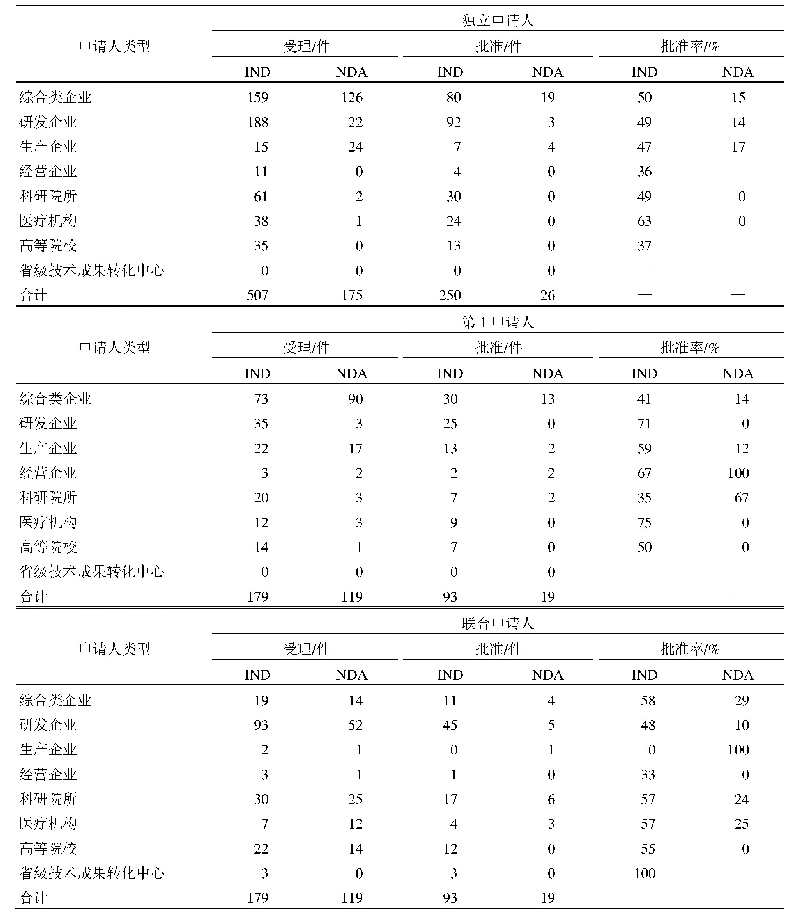
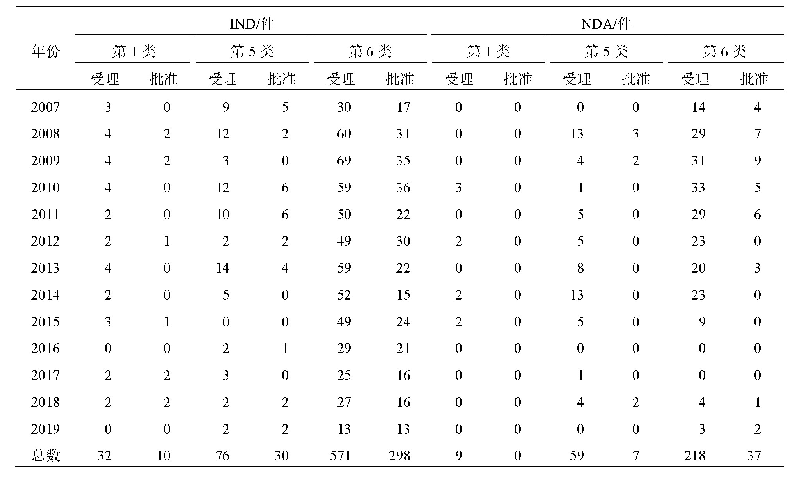
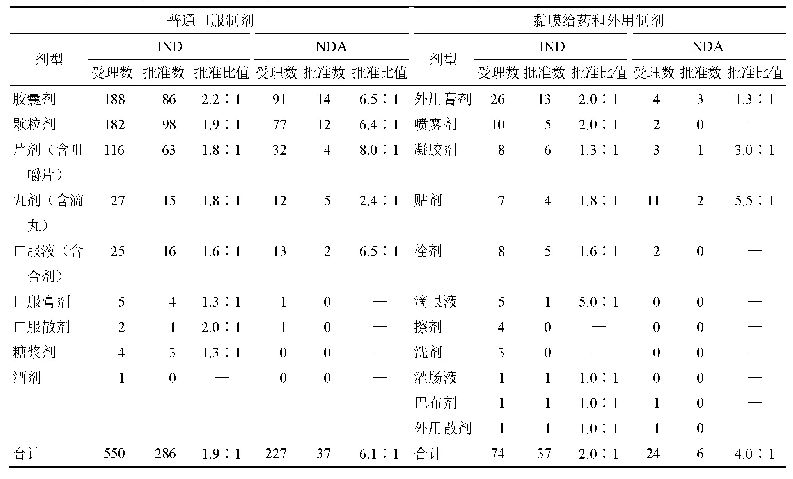
《表3 2016-2019年美国拓展性同情用药申请与批准量[12]》
注:*表示统计数据中包括向CBER提出的123个申请,52个获得批准的数据,批准率大约只有50%,这是因为其中有大量的单个患者申请同一产品的非紧急使用,FDA认为患者承担相关产品此类使用风险是不合理的,或者批准的理由不充分。除此类情况,向CBER提出的申请有91%获得批准。
虽然有声音批评FDA的拓展性使用程序繁琐,增加了使用负担,但FDA认为总体上效果良好。在批准时限上,FDA规定的是30天默示批准,不过通常在收到申请后都会很快做出决定,单个患者的紧急使用一般少于1天,非紧急使用一般8~26天[FDA药品评价与研究中心(Center for Drug Evaluation and Research,CDER)平均7.8天,FDA生物制品评价与研究中心(Center for Biologics Evaluation and Research,CBER)平均25.9天],中等规模患者和治疗性使用保证在30天时限内完成审查[11]。而且每年大约1000多件申请,大部分都会得到批准,单个患者的同情用药申请批准率基本在99%以上(见表3),不批准的也会说明理由。
| 图表编号 | XD00216370200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.20 |
| 作者 | 仲宣惟、韩若斯、李波 |
| 绘制单位 | 中国食品药品检定研究院、中国食品药品检定研究院、中国食品药品检定研究院 |
| 更多格式 | 高清、无水印(增值服务) |
![《表3 2016-2019年美国拓展性同情用药申请与批准量[12]》](http://bookimg.mtoou.info/tubiao/gif/ZGYS202012010_04600.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式