《表1 2012—2017年美国同情用药申请量与批准率[1]》
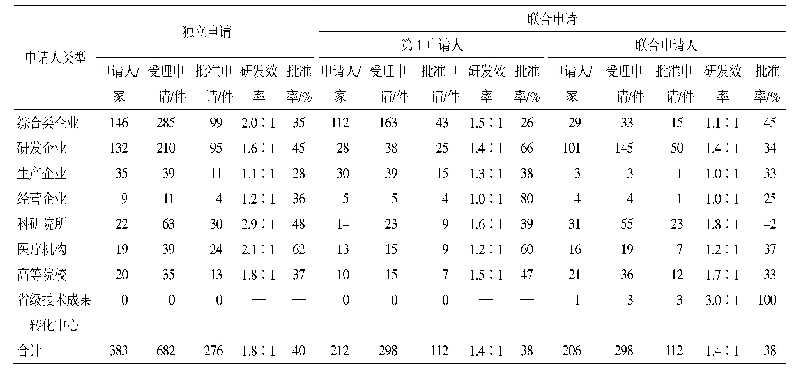
FDA在同情用药审批上实行严格把关、高批准率的原则。对于大规模人群的同情用药申请,FDA要求必须找到足够的安全性和有效性证据;而对于单个患者的申请,则只需医师判断IND治疗风险低于疾病本身即可[9]。近年来,FDA平均每年收到上千份同情用药申请,批准率约99%,但其中约11%的申请为修改后批准的,修改问题主要涵盖试验药物剂量、患者的安全监测等方面。FDA官网公布了2012—2017年间药品评价和研究中心(Center for Drug Evaluation and Research,CDER)和生物制品评价和研究中心(Center for Biologics Evaluation and Research,CBER)同情用药申请的接收量和批准率(见表1)[1],从中可发现:各类同情用药申请批准率均很高,特别是治疗性IND,除2016年2个未通过外,其余年份批准率均为100%;申请类别较多的是单个患者非紧急情况IND和单个患者紧急情况IND,且前者每年均呈现正增长,2016年开始超过1000份。该结果也印证了不断完善同情用药法规、提升申请效率的系列举措,极大地促进了同情用药、尤其是单个患者同情用药的发展。
| 图表编号 | XD00165605900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.07.01 |
| 作者 | 高杨、梅丹、李大魁、张波、胡扬、左玮、赵蕾蕾、张鹏霄、王少红 |
| 绘制单位 | 中国医学科学院北京协和医学院北京协和医院药剂科、中国医学科学院北京协和医学院北京协和医院药剂科、中国医学科学院北京协和医学院北京协和医院药剂科、中国医学科学院北京协和医学院北京协和医院药剂科、中国医学科学院北京协和医学院北京协和医院药剂科、中国医学科学院北京协和医学院北京协和医院药剂科、中国医学科学院北京协和医学院北京协和医院药剂科、中国医学科学院北京协和医学院北京协和医院药剂科、中国医学科学院北京协和医学院北京协和医院药剂科 |
| 更多格式 | 高清、无水印(增值服务) |
![《表1 2012—2017年美国同情用药申请量与批准率[1]》](http://bookimg.mtoou.info/tubiao/gif/LCYW202007020_00600.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
![表3 2016-2019年美国拓展性同情用药申请与批准量[12]](http://bookimg.mtoou.info/tubiao/gif/ZGYS202012010_04600.gif)