《表1 FDA收录的眼用制剂品种规格及推荐的生物等效性评价方法[3-39]》
FDA《特定药物的生物等效性指导原则》推荐的眼用制剂生物等效性试验方案大概分为3种:(1)体外实验。(2)以药动学为终点的体内生物等效性试验。(3)临床终点生物等效性试验。不同品种推荐方法见表1。对于局部起效的溶液型眼用制剂,如果其化学性质和制造过程都足以证明生物等效性,可通过体外试验给予体内生物等效性研究豁免。有些品种可以开展类似口服固体制剂的以药动学为终点的体内生物等效性试验,通过检测眼局部靶组织的药物浓度,计算药动学参数评价仿制制剂与参比制剂的等效性。对于一些局部起效的眼用制剂,没有确定的药效学标志物,但具有可接受的临床终点指标或替代终点指标,只能采用临床终点生物等效性试验评价仿制制剂和参比制剂的等效性。
| 图表编号 | XD0099622100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.30 |
| 作者 | 刘倩、南楠、张广超、许鸣镝 |
| 绘制单位 | 中国食品药品检定研究院、中国食品药品检定研究院、中国食品药品检定研究院、中国食品药品检定研究院 |
| 更多格式 | 高清、无水印(增值服务) |
![《表1 FDA收录的眼用制剂品种规格及推荐的生物等效性评价方法[3-39]》](http://bookimg.mtoou.info/tubiao/gif/ZXYZ201918006_00601.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式




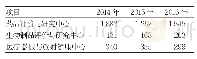
![表4 受试制剂与参比制剂生物等效性结果[几何均数比值(90%置信区间)]](http://bookimg.mtoou.info/tubiao/gif/XYYL202101008_08600.gif)