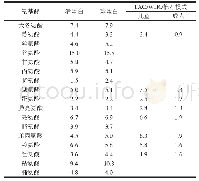
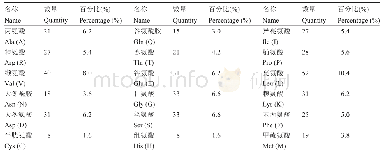
《表2 与锌结合的食物源蛋白及氨基酸序列(组成)》
注:a代表该肽的锌离子结合能力单位是μg/mg;b代表单分子肽结合锌的摩尔数。
半胱氨酸是锌结合蛋白中的特定氨基酸,锌指结构是能特定结合一个或多个锌原子的核酸结合蛋白模体,其中C6锌指结构富含半胱氨酸,研究结果表明C6锌指结构仅与半胱氨酸残基结合[24]。锌由肠腔进入黏膜细胞后,金属硫蛋白会与锌结合起动态调控的作用。每一种金属硫蛋白由60~68个氨基酸组成,其中含有20或21个半胱氨酸。金属酶乙醇脱氢酶中存在的与锌结合的配体也是以半胱氨酸为主。来自乳酪蛋白的酪蛋白磷酸肽(CPP)以其金属螯合能力而闻名,并已在许多基于牛乳的婴儿配方食品中作为饮食矿物质载体而商业化。许多已鉴定的CPP通常包含3个磷酸化丝氨酸残基的独特序列和2个谷氨酸残基,其结构[Ser(P)-Ser(P)-Ser(P)-Glu-Glu]被认为具有主要的金属螯合位点。另外,1种CPP的序列为Glu-Ser(P)-Ser(P)-Ser(P)-Glu-Glu,可以螯合6个锌离子。很多研究也通过红外光谱研究表明:在肽C端,丝氨酸和苏氨酸残基的羟基以及天冬氨酸和谷氨酸侧链的羧酸阴离子参与锌螯合[21]。多肽中存在的谷氨酸残基,特别是多聚谷氨酸残基能够提高自身对过渡态金属离子的结合能力,这大概与其侧链的-COOH能够改变局部的电荷密度有关。Wang等从酪蛋白水解物中鉴定出的锌离子结合活性肽中有高含量的谷氨酸、丝氨酸和缬氨酸残基。也有研究通过傅里叶变换红外光谱证明了谷氨酸、丝氨酸、天冬氨酸和苏氨酸的侧链碳氧以及羧酸根离子在肽锌结合物中起着重要的作用[25]。曹等利用类蛋白修饰的方法从牡蛎中分离出一条具有较高活性的肽,并采用分子力学模拟的方法得到该条多肽与锌结合的位点,该肽中的3个谷氨酸Glu-1、Glu-5和Glu-6侧链羧基上的羰基氧和羟基氧均参与了锌离子的配位,同时主链上的部分羰基氧也参与锌离子的配位[26]。易与锌离子结合的氨基酸序列包含一个或多个组氨酸残基已被以前的研究所证实。另外,处于肽链N端的组氨酸与C端的相比有更强的金属离子结合能力。有研究表明,从芝麻蛋白中分离出的Asn-Ser-Met肽段的锌离子结合能力比还原型谷胱甘肽的锌离子结合能力还要高[20]。因此推测在氨基末端的天冬酰胺残基起着重要的作用。精氨酸和天门冬氨酸也往往显示出较强的锌离子结合能力。如表2所示,从不同食物来源的蛋白提取出的具有与锌结合能力的肽段中出现频率较高的氨基酸有谷氨酸、丝氨酸、精氨酸、赖氨酸等氨基酸。锌离子与肽的结合强弱与肽链的氨基酸组成密切相关。虽然它们的氨基酸序列不同,但是由于其氨基酸侧链中含有亲水性基团(-OH、-NH2、-COOH等),因此都能与锌离子通过配位键结合。
| 图表编号 | XD007333200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.11.20 |
| 作者 | 李钰金、赵元晖、解万翠、杨锡洪、梁兴国 |
| 绘制单位 | 中国海洋大学食品科学与工程学院、中国海洋大学食品科学与工程学院、青岛科技大学海洋科学与生物工程学院、青岛科技大学海洋科学与生物工程学院、中国海洋大学食品科学与工程学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式