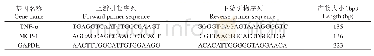
《表1 荧光定量引物列表Tab.1 The primers of qRT-PCR used in this study》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《大豆bHLH转录因子家族成员的进化及功能分化研究》
大豆种子(Williams 82)使用50 m L 7%次氯酸钠和2 m L浓盐酸消毒16~20 h.将消毒后的种子放入用无氮营养液浸湿的蛭石/珍珠岩为1∶1的介质中,25℃黑暗培养2 d.转为25℃、光照(16h)/黑暗(8 h)条件下培养5 d后,将用无菌水洗涤后重悬的OD600为0.8左右的USDA110菌株浇到大豆根部.每3 d浇一次无氮营养液.取大豆不同组织样品于液氮中迅速冷冻,随后放入-80℃冰箱中冷藏.用Trizol Reagent(Invitrogen)提取不同时期大豆材料不同组织材料的总RNA.使用NANODROP ONE(Thermo)检测RNA样品浓度和纯度,记录数值.RNA样品置于-80℃保存.使用TIANGEN公司反转录试剂盒操作说明反转录获得cDNA第1链,将其在-20℃保存.随后以其为模板按照BIOTAKE公司Power 2×SYBR Real-time PCR Premixture操作说明进行qRT-PCR反应(LightCycler 96,Roche).根据大豆bHLH基因CDS序列设计荧光定量引物(表1),内参基因为大豆β-actin基因.qRT-PCR反应体系为10μL Power 2×SYBR Premixture,0.6μL Forward Primer(10μm),0.6μL Reverse Primer(10μm),1μL cDNA,2.0μL ROX,3.8μL灭菌蒸馏水至20μL反应体系.采用三步法反应,PCR反应程序为95℃预变性2 min;95℃变性20 s,58℃退火20 s,72℃延伸20 s;45个循环.每个样品进行3次生物学重复,根据CT值进行目标基因相对表达量2ΔΔCT的计算[19].
| 图表编号 | XD0060284200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.10 |
| 作者 | 程琳、薛亚杰、付觉民、刘旭阳、曲骁冲、代幸龙、董沛峰、徐月霞、洪一峰、姚远、赵基海 |
| 绘制单位 | 信阳师范学院生命科学学院、信阳师范学院生命科学学院、鸡公山自然保护区、信阳师范学院生命科学学院、信阳师范学院生命科学学院、信阳师范学院生命科学学院、信阳师范学院生命科学学院、信阳师范学院生命科学学院、信阳师范学院生命科学学院、信阳师范学院生命科学学院、信阳师范学院生命科学学院 |
| 更多格式 | 高清、无水印(增值服务) |